
题目列表(包括答案和解析)
4.下列各组物质中不易用物理性质区分的是 ( )
A.苯和四氯化碳 B.酒精和汽油
C.碘和高锰酸钾固体 D.氯化铵和硝酸铵晶体
3.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是 ( )
A.常温下,“纳米铜”与铜片的还原性相同; B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”比铜片的金属性强; D.常温下,“纳米铜”比铜片的氧化性强
2.下列实验操作会导致实验结果偏高的是 ( )
A.用NaOH标准液测定未知浓度的盐酸时,滴定后滴定管尖嘴部分存在一段空气
B.测定中和热实验中,两只烧杯口不相平
C.测定硫酸铜晶体结晶水含量的实验中,加热分解后的样品置于空气中自然冷却
D.配制0.1 mol·L-1 NaCl溶液时,定容时俯视刻度线
1.下列关于蛋白质的叙述中,不正确的是 ( )
A.蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解
B.人工合成具有生命活力的蛋白质-结晶牛胰岛素是我国科学家1965年首次合成的
C.重金属盐能使蛋白质凝结,所以误食重金属盐会中毒
D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生颜色反应
23.钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80 g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用含m的代数式表示)
22.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1) 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。
反应的化学方程式是__________________________。
样品中铝的质量是_____________g。
(2) 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_____________,氧化铁与铝的质量比是_____________。
(3) 待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=_____________。
21.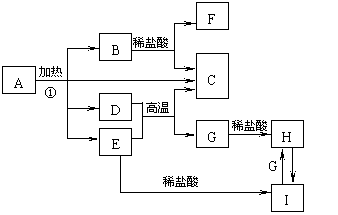 化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
20.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
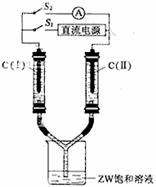 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
19.⑴镁.锌和铝都是活泼金属,镁的氢氧化物只溶于强酸,而锌和铝其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________。
a.硫酸铝和氢氧化钠 b.硫酸铝和氨水 c.硫酸锌和氢氧化钠 d.硫酸锌和氨水
⑶写出可溶性铝盐与氨水反应的离子方程式_________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原_ _。
⑵用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象得出的结论是
(A)实验中发生的反应都是氧化还原反应 (B)铝是一种较活泼的金属
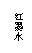
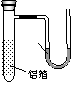 (C)铝与氧气反应放出大量的热量
(D)铝片上生成的白毛是氧化铝和氧化汞的混合物
(C)铝与氧气反应放出大量的热量
(D)铝片上生成的白毛是氧化铝和氧化汞的混合物
18.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
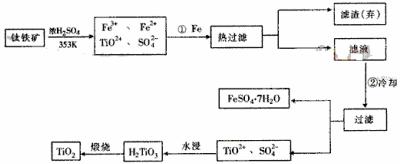
(1) Ti的原子序数为22,Ti位于元素周期表中第 周期,第 族。
(2) 步骤①加Fe的目的是 ;
步骤②冷却的目的是 。
(3) 上述制备TiO2的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
(4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
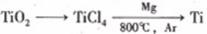
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
反应TiCl4+2Mg=2MgCl+Ti 在Ar气氛中进行的理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com