
题目列表(包括答案和解析)
16.下列离子方程式中正确的是
A.硫化亚铁放入盐酸中 S2- + 2 H+ = H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S = CuS↓ + 2 H+
C.氯化铝溶液中加入过量氯水 Al3+ + 4NH3•H2O = AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- = CO32- + H2O
15.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成
ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料 B.电解过程中阳极附近溶液的pH明显升高
C.阳极反应方程式为:2Cl--2e-=Cl2↑
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
14.下列说法正确的是
A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB
B.相同条件下将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前
者大
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是
C(Na+)>C(CH3COO-) >C(OH-) >C(H+)
D.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
13.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.分散系的分类: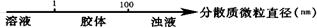
B.常温条件下,酚酞的变色范围: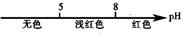
C.HCl和NaAlO2溶液反应后铝元素的存在形式:


D.CO2通入澄清石灰水中反应的产物: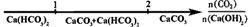
12.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性 B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
11.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,2.24L苯中约含有3.612x1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
10.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e- B.O2+4H++4e-=2H2O
C.H2=2H++2e- D.O2+2H2O+4e-=4OH-
9.有M、N两溶液,各含有下列十四种离子中的七种离子: Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B. AlO2-、MnO4-、SO42-
C.Cl-、NO3-、SO42- D. MnO4-、SO42-、NO3-
8.一定温度下,在质量都是50 g的五份水中分别加入30g、40g、50g、60g、70gKNO3固体,充分搅拌后,滤去未溶解的KNO3。加入的KNO3质量与相应所得溶液的质量数据见下表:
|
加入KNO3的质量/ g |
30 |
40 |
50 |
60 |
70 |
|
溶液质量/ g |
80 |
90 |
100 |
105 |
105 |
则该温度下KNO3的溶解度是
A.60克 B.80克 C.100克 D.110克
7.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内
装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
|
① |
② |
③ |
 ④ ④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com