
题目列表(包括答案和解析)
19.(10分)已知FeSO4在高温下分解生成Fe2O3、SO3和气体SO2。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
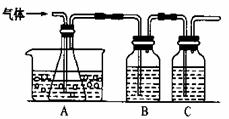
请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是; ;
(2)A瓶内所盛试剂的作用是 ,A瓶要用冰水冷却的原因是
(3)检验后,用A瓶内的混合物测定FeSO4已分解的质量,其实验操作的第一步是(简述操作步骤)
。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为
a1g,再次灼烧并冷却至室温称量其质量为盘a2 g,且a2 <a1,接下来的操作应当是
。
(5)已经分解的FeSO4的质量是 (填计算式)。
17.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
下列说法正确的是( )
A.CuSO4是氧化剂,FeS2既是氧化剂又是还原剂
B.当生成7molCu2S时,共转移电子21mol
C.产物中的SO42-离子全部是氧化产物
D.该反应中氧化剂、还原剂的物质的量之比为14︰5
16.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
A.HCl和CO B.HCl、H2和CO C.CH4和NH3 D.HCl、CO和CO2
15.下列叙述正确的是
A. 1mol SiO2含有的Si-O键个数为1.204×1024
B. 标准状况下,11.2LSO3含3.01×1023个分子
|
D.2C+SiO2==Si+2CO,该反应说明碳金属性强于硅。
14.下列反应的离子方程式书写正确的是( )
 A、偏铝酸钠溶液中加入少量硫酸氢钠溶液: AlO2- + H+ + H2O ==
Al(OH)3
A、偏铝酸钠溶液中加入少量硫酸氢钠溶液: AlO2- + H+ + H2O ==
Al(OH)3
B、亚硫酸钠溶液与双氧水混合:SO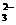 +2H2O2===SO
+2H2O2===SO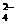 +2H2O+O2↑
+2H2O+O2↑
C、次氯酸钙溶液中通入过量的二氧化硫气体:ClO- + SO2 + H2O == HClO + HSO3-
 D、足量CO2通入NaSiO3溶液中
:CO2+SiO32-+H2O=CO32-+H2SiO3
D、足量CO2通入NaSiO3溶液中
:CO2+SiO32-+H2O=CO32-+H2SiO3
13.化学实验室中常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,将BaCl2溶液用HNO3酸化
B.检验溶液中是否含有Fe2+时,用硝酸酸化后,加入KSCN溶液
C.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰的条件下,所加的BaCl2溶液用盐酸酸化。
12. 能够确定一种溶液中一定含有SO42-的事实是 ( )
A.取少量试样溶液,加入用硝酸酸化过的BaCl2中,有白色沉淀生成
B.取少量试样溶液,加入BaCl2溶液,有白色沉淀,再加稀HNO3有白色沉淀生成
C.取少量试样溶液加入Ba(NO3)2溶液,有白色沉淀,,该沉淀不溶于稀盐酸。
D.取少量试样溶液加入足量的盐酸无沉淀,加入BaCl2,有白色沉淀生成
11.下列溶液中,不能区别SO2和CO2气体的是 ( )
A.石灰水 B.品红溶液 C.溴水 D.NaOH溶液
10.下列变化中可以说明SO2具有漂白性的是( )
A.SO2通入酸性高锰酸钾溶液中红色褪去 B.SO2通入品红溶液红色褪去
C.SO2通入溴水溶液中红棕色褪去 D.SO2通入氢氧化钠与酚酞的混合溶液红色褪去
9.碲元素及其化合物不可能具有的性质是 ( )
A.碲的化合物有-2、+4、+6价
B.碲的氧化物有TeO2和TeO3
C.碲能与氢气直接化合,且H2Te比H2Se稳定
D.单质碲为银白色、导电性比硒强的固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com