
题目列表(包括答案和解析)
1.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.酒精 C.氟里昂 D.含汞电池
23.(7分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的物质的量.
(2)若在反应后的溶液中加入足量的锌粉,充分反应后放出标准状况下的气体3.36L,则原浓硫酸中溶质的物质的量是多少?
22.(1 0分)(1)反应的化学方程式
(2)
(3)在一定条件下,甲与O2反应的化学方程式是
(4)丁的元素符号是 ,其原子结构示意图为
(5)丁的氧化物的晶体结构与 的晶体结构相似。
21.(12分)
①I在 中进行,反应II在 (均填设备名称)中进行。
②反应I的化学方程式是
反应II的方程式是_____________________。
(2)①甲的电子式是
②D的溶液与乙反应的离子方程式是
③该反应的热化学方程式:
20. (10分)(1)原溶液中一定存在离子是 ,一定不存在的离子是 。
(2)上述①~③的操作中, 是无意义的,应改为
,以便确定 离子是否存在。
(3)为确定 离子是否存在,应补充的操作是
。
19.(10分)
(1)水中滴有数滴 溶液, NaOH溶液的作用是; ;
(2)A瓶内所盛试剂的作用是 ,A瓶要用冰水冷却的原因是
(3)检验后,用A瓶内的混合物测定FeSO4已分解的质量,其实验操作的第一步是(简述操作步骤)
。
(4) 。
(5)已经分解的FeSO4的质量是 (填计算式)。
23.(7分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的物质的量.
(2)若在反应后的溶液中加入足量的锌粉,充分反应后放出标准状况下的气体3.36L,则原浓硫酸中溶质的物质的量是多少?
高三第一轮复习(氧族元素单元测试)
第I卷(选择题51分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22.(1 0分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙为双原子分子,丙为负二价阴离子。丁为原子,它的最外层电子数是其次外层电子数的一半。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
(3)在一定条件下,甲与O2反应的化学方程式是
(4)丁的元素符号是 ,其原子结构示意图为
(5)丁的氧化物的晶体结构与 的晶体结构相似。
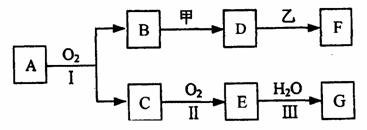
21.(12分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的
浓溶液中发生钝化。
(1)若A为某种矿石的主要成分,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在 中进行,反应II在 (均填设备名称)中进行。
②反应I的化学方程式是 反应II的方程式是_____________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、C的浓溶液并使它们接近,有大量白烟生成。则①甲的电子式是
②D的溶液与乙反应的离子方程式是
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
20. (10分)某溶液中可能含有Na+、K+、Mg2+、I-、SO32-、SO42-等离子中的全部或其中的几种。现分别进行以下操作:
①用洁净的铂丝蘸取溶液在无色火焰上灼烧,焰色呈黄色;
②取原溶液,滴加少量溴水,振荡后溶液仍为无色。
③取原溶液,加入盐酸酸化的Ba(NO3)2溶液后,产生白色沉淀。
(1)原溶液中一定存在离子是 ,一定不存在的离子是 。
(2)上述①~③的操作中, 是无意义的,应改为
,以便确定 离子是否存在。
(3)为确定 离子是否存在,应补充的操作是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com