
题目列表(包括答案和解析)
21. (11分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(11分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(1)写出实验室制取A的化学方程式:___ ;
(2)写出D→E的化学方程式:__ __;
(3)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:__ _ ;
(4)写出酯K的结构简式:____ __。
20. (8分)拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
(8分)拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
|
气体 |
a |
b |
c |
d |
|
CO2 |
盐酸 |
CaCO3 |
饱和Na2CO3溶液 |
浓硫酸 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥纯净的这种气体是______
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体___ 理由是___ ___;
②气体_____ _理由是____ __;
③气体_____ _理由是__ ____;
④气体_____ _理由是_ _____。
19.(11分)不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n(n = 1,3,5,7;且非金属性X′>X)。卤素互化物的结构性质与卤素单质相似。回答下列问题:
(1)在IBr中碘元素的化合价是 ,IBr应属于 晶体。IBr与氢氧化钠溶液反应的离子方程式是 。
(2)在所有卤素互化物中,沸点最低的应是 (写分子式,下同)。
(3)若n = 7,则最可能生成的卤素互化物应为 。
(4)某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,则n= 。
18.(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)
若反应进行到某时刻 时,
时, (N2)=13 mol,
(N2)=13 mol,  (NH3)=6 mol,则a=
(NH3)=6 mol,则a=
(2)
反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量 (NH3)=
(NH3)=
(3) 原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
 (始):
(始): (平)=________________。
(平)=________________。
(4)
达到平衡时,N2和H2的转化率之比, (N2):
(N2): (H2)_______。
(H2)_______。
(5)
平衡混合气体中, (N2):
(N2): (H2):
(H2): (NH3)_____________。
(NH3)_____________。
17.(10分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为________元素(填名称,下同),B为_______元素, D为_______元素,
(2)C元素在周期表中属第________周期,________族元素;
(3)D与B形成的化合物的电子式______ ,属________晶体;
(4)C与E形成的化合物的电子式为___________和___________,属______晶体.
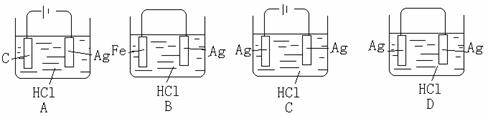
16.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是:
15.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
14.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+C12(g)=2HCl(g);△H = -184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H == -802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(1);△H == -571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H = -283kJ/mol
13.下列有关说法中,错误的是
A、NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B、在石墨晶体中,碳原子与共价键的个数比为2:3
C、三种氢化物的沸点高低:HBr>HCl>HF
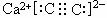 D、CaC2的电子式为
D、CaC2的电子式为
12. 将反应Mn2++BiO3-+H+→MnO4-+Bi3++H2O配平后
将反应Mn2++BiO3-+H+→MnO4-+Bi3++H2O配平后 的化学计量数为
A、8
B、10 C、14 D、30
的化学计量数为
A、8
B、10 C、14 D、30
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com