
题目列表(包括答案和解析)
17.(10分)已知X和Y是由两种中学常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性化合物,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为C的澄清溶液,X、W、E的焰色反应均为黄色。X~G各物质之间的关系如图(部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
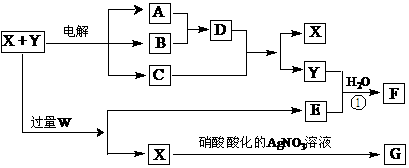
⑴X、Y、W的化学式分别为_____________________________________;
⑵写出反应①和电解开始时的离子方程式:
① ;② ;
⑶若要在电解后期得到C的澄清溶液,X和Y必须满足的条件是:____ _ 。
⑷向C的澄清液中加入1mol/L的硫酸,当加至50mL时才开始出现沉淀。假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100ml,原Y溶液的物质的量浓度为amol/L,则原X溶液的物质的量浓度为 mol/L。
16.(3分)某无色溶液可能含有下列离子中的几种:H+、Mg2+、Na+、Ag+、Cl-、OH-、HCO3-、NO3-,已知该溶液能和金属铝反应,放出的气体只有氢气。试推断:若溶液和铝反应后有AlO2-生成,则原溶液中一定大量含有的离子是___ __ _,还可能有较大量的离子是_____ _;若溶液和铝反应后有Al3+生成,则原溶液中一定不大量含有的离子是__ ____。
15.(2分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)已知:2Fe + 3/2O2 = Fe2O3,△H = -Q1 kJ/mol; 2Al + 3/2O2 = Al 2O3,△H = -Q2 kJ/mol ,则Q1 Q2(填“>”,“<”或“=”);
(2)已知:CaCO3(s) == CaO(s) + CO2(g);ΔH=178.2kJ·mol-1,该反应自发进行的条件是 。
14.(6分)已知: NO3-+4H++3e→NO+2H2O 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_________
________________________________。
13.在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述正确的是
A.在实验过程中水的电离程度的变化趋势是先减小后增大
B.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)=c(Cl-)
C.当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl
D.若滴加盐酸后,溶液pH >7,则此时溶液中溶质一定是NH4Cl和NH3·H2O
第Ⅱ卷
12.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A
= H+ + HA-,HA- H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
11.下列反应的离子方程式正确的是
①亚硫酸钠溶液中加入硝酸:SO32-+ 2H+ = H2O + SO2↑
②澄清石灰水跟稀硝酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
③向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3↑+2H2O
④0.1molFeBr2中滴入含Cl20.1mol氯水:2Fe2++4Br-+3Cl2=2Fe3++2Br2 +6Cl-
|
⑥硫化钠的水解:S2-+ 2H2O 
 H2S + 2OH-
H2S + 2OH-
⑦向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++ HCO3- +OH-=CaCO3↓+H2O
⑧苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO 32-
A.③⑤ B.①③ C.③⑤⑥ D.①②④⑥
10.25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,正确的是
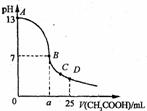 A、B点的横坐标a=12.5
A、B点的横坐标a=12.5
B、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D、曲线上A、B间任一点,溶液中都有:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
9.对于平衡:2A+2B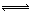 C+2D+3E+H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判断正确的是:
C+2D+3E+H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判断正确的是:
A.加水平衡左移
B.增加A,可提高B的转化率
C.平衡后,按起始投料比,再次投入A和B,则A和B的转化率都将增大
D.升温该平衡一定发生移动。
8.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com