
题目列表(包括答案和解析)
18. (12分)下面是关于硫化氢的部分文献资料
(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
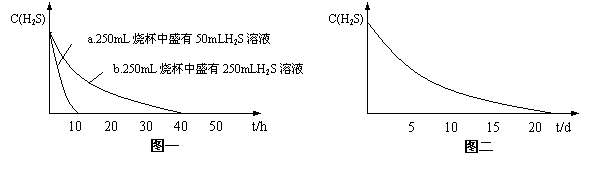
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
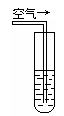
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
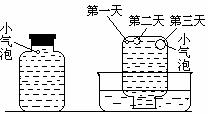 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应_____ __
___ _______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
17.(10分)
[发现问题]研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
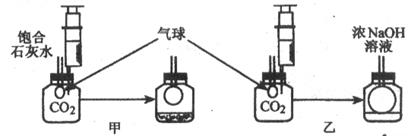
[实验探究]在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。
实验装置和现象如图所示。请你一起参与。
|
[现象结论]甲装置中产生该实验现象的化学方程式为 。
解释通常用石灰水而不用NaOH溶液检验CO2的原因
;乙装置中的实验现象是 。
吸收CO2较多的装置是 。
[计算验证]另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通过吸收CO2应该用饱和石灰水。
[思考评价]请你对小李同学的结论进行评价:
。
16.(5分)下面a-e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是 (填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
27、(12分)某芳香烃A有如下转化关系: 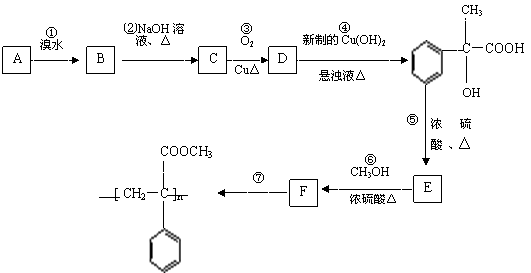
⑴.反应②和⑤的类型:②属于 反应;⑤属于 反应;
⑵.A、F结构简式:A ;F ;
⑶.反应③、⑥的化学方程式:
③ ;
⑥ ;
⑷.D还可以和新制的银氨溶液反应,化学反应方程式为:
。
26、(18分) 工业生产硝酸铵的流程图如下:
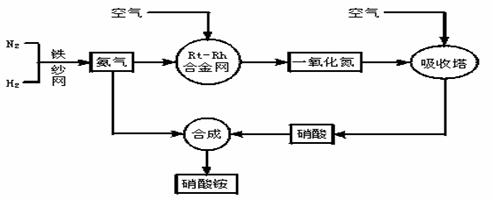
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)。
(2)已知N2(g) +3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是 。
②为有效提高氢气的转化率,实际生产中宜采取的措施有 。
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
③该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响)。其原因是_____________________________________。
(3)写出氨被加热的铂铑合金网催化氧化的化学方程式:_______________________________________________________________________
(4) 一定温度下在体积固定的密闭容器中,将3mol H2和1mol N2混合,当该反应达到平衡时,测得平衡混合气的压强是反应前的0.85倍,此时N2的转化率为__________。
25、(10分)下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
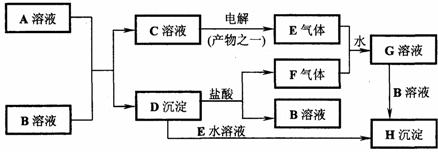
试回答:
(1)写出化学式:A_______________;B_______________。
(2)写出下列反应的离子方程式:
①C→E:_________________________ _____;
②D→H:___________________________ ___;
③E+F+H2O→G:______________ ________________。
24、(8分)某些化学反应可用下式表示
A + B ─→ C + D + H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
23、(16分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下:6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂是
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 溶解、分液 (b) 过滤、洗涤 (c) 蒸发、结晶 (d) 冷却、称量 (e)烘干或灼烧
22、(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅
速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I- [AgI2]-。
[AgI2]-。
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再在所得的黄色沉淀中滴加浓KI溶液,现象为 。
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原
因 。
(3)丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。
大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单
的实验说明不会产生AgCl沉淀: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com