
题目列表(包括答案和解析)
3.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.相同质量的N4和N2所含原子个数比为2:1
C.N4是N2的同位素 D.N4的沸点比N2高,N4的化学性质比N2更稳定
2.已知25℃、10lkPa条件下:
4Al(s)+3O2(g)=2Al2O3(s) △H=-2834.9kJ·mol-1;
4Al(s)+2O3(g)=2Al2O3(s) △H=-3119.1kJ·mol-1 由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
1.下列叙述正确的是:
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
 27 (10分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色理念。
27 (10分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色理念。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸.c中反应的化学方程式是 .再由a向e中加2 mL蒸馏水,c中的实验现象是 .
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
再由a向c中加2 mL蒸馏水,c中的实验现象是 .
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2.操作步骤为 ,
实验现象为 ;但此实验的不足之处是 .
28(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反
应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被
烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数
据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
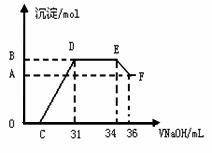 (1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
上述现象说明溶液中____________结合OH-的能力比 强(填离子符号)。
(3)B与A的差值为 mol。
(4)C点对应的氢氧化钠溶液的体积为 mL

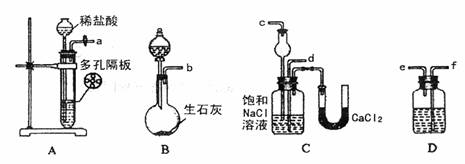
26(15分)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了杰出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、CO2为原料先制得NaHCO3,再生产出纯碱。下面是实验室模拟“侯氏制碱法”制取NaHCO3的实验步骤:第一步:连接好装置,检验气密性,在各仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解中,再通入另一装置
中产生的气体,片刻后C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,并用蒸馏水洗涤晶体,得到NaHCO3固体。
第四步:向滤液中通氨气,加入细小食盐颗粒,冷却析出副产品NH4Cl晶体。
 请回答下列问题:
请回答下列问题:
(1)装置的接口连接时a接 。
D中所盛试剂的名称是 。
(2)第二步中必须先让 (填编号)装置发生反应。
(3)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内产生固体的总化学方程式为 。
(4)第二步中蒸馏水洗涤晶体的目的是除去 杂质(以化学式表示)。
(5)向滤液中通氨气的目的是 。(填序号)
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1 ~ 2滴酚酞指示剂,用物持的量浓度为c mol/L的HCl溶液滴定至溶液由红色到无色(指示CO32 + H+ = HCO3-反应的终点),所用HCl溶液体积为V1mL,再加1 ~ 2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2mL。写出纯碱样品中NaHCO3质量分数的计算式:ω(NaHCO3) =
24(13分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关试验,实验结果如下图所示:


试回答下列问题:
(1)沉淀甲是:___________________________,
(2)沉淀乙是:____________,由溶液甲生成沉淀乙的离子方程式为:_________________.
(3)沉淀丙是:__________________.
(4)气体甲成分可能有哪几种?(可以不填满也可以补充)
25(12分)
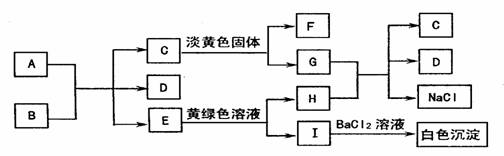 下图是A~I九种物质之间的转化关系,其中部分生成物和反应条件已略去。已知A为非金属固态单质,C、F、E常温下都是无色气体。
下图是A~I九种物质之间的转化关系,其中部分生成物和反应条件已略去。已知A为非金属固态单质,C、F、E常温下都是无色气体。
请填空:
(1)C的固体属于 晶体,C的电子式是 。
(2)A与B反应的化学方程是 。
(3)G与H反应的离子方程式是 。
E转变为H和I的化学方程是 。
(4)C转变为F和G的化学方程式是(若是氧化还原反应,标出电子转移方向和数目)
21(8分)(1)下列说法中,正确的是(填序号)_____________
A AgCl+NaBr=AgBr+NaCl能在水中进行,是因为AgBr比AgCl更难溶于水
B 用渗析法分离淀粉中混有的氯化银杂质
C 可以用分液漏斗将甘油和水的混合液体分离
D 用碱式滴定管量取20.00毫升高锰酸钾溶液
E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F 在氢氧化铁胶体中加入少量硫酸会产生沉淀
G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
(2)下列实验操作或事故处理中,正确的做法是 (选填序号)
A.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10%NaOH溶液
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
F.不慎接触过多的氨,及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛
G. 用结晶法可以除去硝酸钾中混有的少量氯化钠
22(12分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是 ;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A、NaOH溶液、酚酞试液 B、KMnO4溶液、稀H2SO4
C、碘水、淀粉溶液 D、氨水、酚酞试液
23(10分)铁合金是金属材料王国的霸主,亚铁盐、铁盐、高铁酸盐等铁的重要化合物也在不同领域中个扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
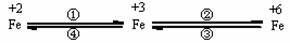
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+20 H+ ==4Fe3+ + 3 O2↑+10 H2O;
4FeO42-+10 H2O== 4Fe(OH)3 + 3 O2↑+8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、金属锌片、惰性电极(或放电物质做电极)材料、蒸馏水及必要的实验仪器完成下列任务:
(1)设计一个实现上述转化④的实验方案(要求产物纯净),写出简要的实验步骤。
(2)在浓碱中,用NaClO可以实现转化②,这一反应的离子方程式为: 。
(3)高铁酸盐是比高锰酸盐更强的氧化剂,研究证明它是一种“绿色环保高效”净水剂,比目前国内外广泛使用的含氯饮用水消毒剂(均为含氯的物质:如漂白粉、氯气和二氧化氯等,它们具有很好的杀菌效果,但不能将水中的悬浮杂质除去,为了除去水中的细微悬浮物,还需另外添加絮凝剂,如聚合铝的氯化物。)的性能更为优良,为什么说它作为净水剂是“绿色环保高效”的? 。
20.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2,下列关于CaOCl2的有关判断不正确的是
A.该混盐与硫酸反应产生1molCl2时转移2NA个电子 B.该混盐的水溶液呈碱性
C.该混盐中的氯元素的化合价为-1价 D.该混盐具有较强的氧化性
第II卷(非选择题 共80分)
19.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28 g乙烯和42g丙烯中均含有6NA对共用电子对
B.32g硫与足量铜完全反应转移的电子数为NA
C.32 g S8单质(结构如右图)中含有的S-S键个数为NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
18、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.干法中每生成1mol Na2FeO4共转移4mol电子
C.湿法中每生成1mol Na2FeO4共转移3mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com