
题目列表(包括答案和解析)
29.
烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
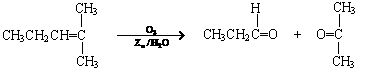
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下;

(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为___________________。
28.
尼泊金酸的结构简式为: 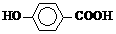
(1)尼泊金酸的分子式为____________。
(2)尼泊金酸不具有的性质是_________(选填序号)。
a. 可溶于水 b. 通常状况下呈固态 c. 发生消去反应 d. 遇FeCl3溶液显紫色
(3)1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a. 4 mol H2 b. 2 mol NaHCO3 c. 2 mol Br2 d. 2 mol Na2CO3
(4)将尼泊金酸与足量NaOH固体混合后灼烧,生成的有机物结构简式为_________________。
(5)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式:
ⅰ酯类___________________________;ⅱ醛类___________________________。
26(A)、为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下三种实验方案:
方案I:取25.00 mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀, 称重,其质量为m2 g
方案Ⅲ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O),消耗KMnO4溶液b mL。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)在方案Ⅲ中滴定时是否需要选择指示剂? _____________ (填“需要”或“不需要”)。滴定终点的颜色变化是_______________________________。
(3)写出Na2SO3固体氧化变质的化学方程式_____________________________________。
(4)用方案Ⅲ的实验数据,计算Na2SO3的纯度为__________________。
(5)实验中发现,方案Ⅱ测定的Na2SO3纯度比方案I和方案Ⅲ的结果都要低得多。试分析产生上述现象的原因
_______________________________________________________________________________________________________________________________________________。
(6)请再设计一个测定Na2SO3固体的纯度的实验方案。
___________________________________________________________________________________________________________________________________________________。
26(B).
下图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸强氧化性并观察还原产物的实验装置。
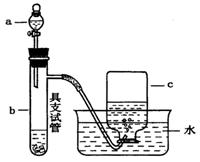
Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中放入约2mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式为_______________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象是___________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是_____________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是__________(填写代号)。
A. c中收集到无色气体;
B. c中收集到的无色气体接触空气后变为红棕色;
C. b中产生的无色气体接触空气后变为红棕色;
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是___________________________________________________________。
Ⅳ.问题讨论
用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因,是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法_________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明。
___________________________________________________________________。
27.
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
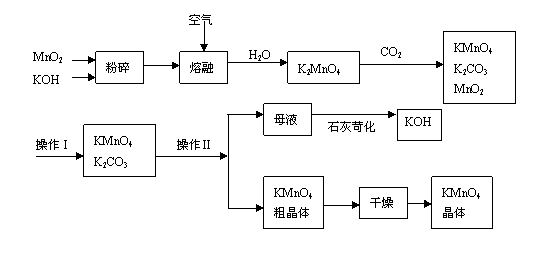

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
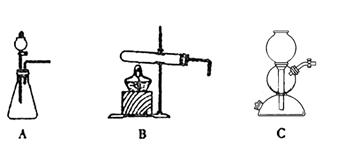
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
25.
甲烷蒸气转化反应为:CH4(g)+H2O(g) CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
已知温度、压强和水碳比[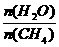 ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
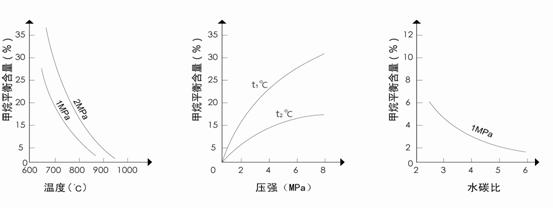
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
(1)该反应平衡常数K表达式为________________________。
(2)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K__________。
(3)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是____________________________。
下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
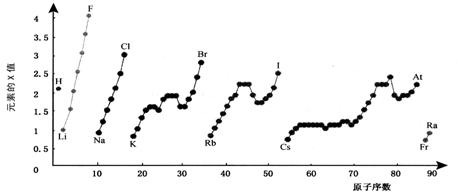
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
23(B)
下图为周期表中原子体积(单质原子的摩尔体积)随原子序数变化的关系。
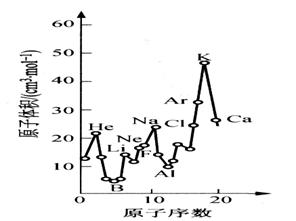
(1)第二周期原子体积最大的元素形成的固态单质属于_________________晶体。第三周期原子体积最小的元素核外电子排布式为_________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有______________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又由小变大
b. 每一周期中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐渐减小
(4)由此可见,在元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律。试写出一条Ⅶ族元素所形成的化合物某种性质的变化规律:
_______________________________________________________________。
24.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:
____________________________________________________。
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
_____________________________________________________。
(3)pH为5-9时,体系中的氧化反应为HI→I2;当pH < 4时,反应方向改变,此时体系中的氧化反应为:_______ → ________。
(4)该反应表明溶液的酸碱性影响物质的______________________(填物质的性质)。
22.充分灼烧a g某含C、H、O元素的有机物时,测得生成了b g CO2和c g H2O,则以下判断正确的是( )
A. 肯定能确定该物质的最简式 B. 肯定不能确定该物质的最简式
C. 肯定不能确定该物质的分子式 D. 肯定不能确定该物质的结构式
第Ⅱ卷 (共84分)
21.以下决定物质性质的因素全面、正确的是( )
A. 元素的化学性质:元素原子的最外层电子数 B. KNO3的溶解度:温度
C. 分子间作用力:相对分子质量 D. 气体摩尔体积:温度、压强
20.原硅酸的分子式为H4SiO4,其分子结构有4个羟基,由若干个原硅酸分子间脱水形成的物质通常用xSiO2·yH2O表示其组成,若有三个原硅酸分子脱水,此过程脱去的水分子数与y的值分别为( )
A. 3、4 B. 2、4 C. 3、3 D. 3、8
19.下列离子方程式正确的是( )
A. 氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42- →BaSO4↓+H2O
B. 饱和碳酸钠溶液通入二氧化碳后溶液浑浊:2Na++CO32-+CO2+H2O → 2 NaHCO3↓
C. 少量SO2用氨水吸收:2NH3·H2O + SO2 → 2NH4+ + SO32- +H2O
D. 往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀:
Al3+ + 2 SO42- + 2 Ba2+ + 3OH - → Al(OH)3↓+ 2BaSO4↓
18.可逆反应A(g)+ B(s)  2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
A. 增大B物质的量 B. 升温 C. 减压 D. 使用适宜催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com