
题目列表(包括答案和解析)
5.下列反应①碳酸氢钙与NaOH溶液反应②苯酚钠溶液与二氧化碳反应③氯气与烧碱稀溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是与石灰水反应 ( )
A.①② B.①③ C.①④ D.②④
4.相同温度浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,测得其c(NH4+)分别为a、b、c(单位mol·L-1)。下列判断正确的是: ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
3.下列叙述中不正确的是 ( )
A.阳离子不一定是金属离子,含有阳离子的物质一定含阴离子
B.阴、阳离子相互作用不一定形成离子化合物
C.分子晶体中一定含有范德瓦尔斯力,含有范德瓦尔斯力的晶体不一定是分子晶体
D.金属晶体的熔点和沸点一般都很高
2.下列叙述中不正确的是 ( )
A.用明矾净化饮用水与胶体有关
B.C(石墨s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
C.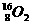 和
和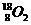 互为同位素,性质相似
互为同位素,性质相似
D.使用太阳能,风能等能源替代传统煤炭既可以降低污染,又可以减少能源危机
1.用NAmol-1表示阿伏加德罗常数。下列说法中正确的是 ( )
A.Cl2摩尔质量与NA个Cl2分子的质量在数值上相等
B.23gNa与足量水反应转移电子数为2NA
C.2.24LCO2中含有的原子数为0.3NA个
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
22、(8分)向某FeBr2溶液中,通入1.12L标准状况下的氯气,完全反应后测得溶液中2c(Br-)=c(Cl-)=0.1mol/L,溶液体积变化和离子水解忽略不计,试求:
(1)原溶液的总体积是多少升?(2)原FeBr2的物质的量浓度多少?
21、(6分)向100mL M(OH)2溶液中加入过量的NaHCO3溶液,生成金属M的碳酸盐沉淀。过滤后,将沉淀与足量的盐酸反应,生成4.48L标准状况下的气体;将滤液加水稀释到250mL,取出25.0mL恰好与20.0mL盐酸完全反应,收集到1.12L标准状况下的气体。
(1)写出M(OH)2溶液和NaHCO3溶液反应的化学方程式。
______________________________________________________________________。
(2)要计算金属M的原子量,你认为_______ ____(填序号)。
A、缺少M(OH)2溶液的物质的量浓度 B、缺少MCO3的质量
C、缺少与MCO3反应的盐酸的物质的量 D、题设条件已足够,不需要补充数据
20、(14分)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),
为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析:(6分)
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32-离子。
(2)定量分析:(8分)该小组同学设计了下图所示装置,测定天然碱的化学组成。

A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
A处碱石灰的作用是 。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为 87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是 。计算推导:该天然碱的化学式为 。
19、(8分)实验室现有下列药品:
固体药品:A、消石灰 B、氯化钠C、二氧化锰 D、氯酸钾 E、铜
液体药品:a、浓盐酸 b、过氧化氢c、饱和食盐水d、浓硫酸 e、浓硝酸 f、氯酸钾。
请选择合适的试剂制取下列气体:
(1)制取O2化学反应方程式是: 。
(2)制取Cl2化学反应方程式是: 。
(3)制取HCl化学反应方程式是: 。
(4)制取NO2化学反应方程式是: 。
18、(12分)X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
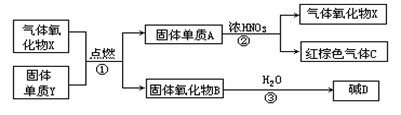
(1)写出有关物质的化学式:X Y A B C D
(2)反应①的反应类型是(填基本反应类型) .
(3)物质B的主要用途是 .
(4)反应② 的化学方程式为: .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com