
题目列表(包括答案和解析)
9.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
8. 做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+→CO2↑+Mn2++
做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+→CO2↑+Mn2++
关于此反应的叙述正确的是
A.该反应的氧化剂是C2O42-
B.该反应右边方框内的产物是OH-C.该反应电子转移总数是5e-
D.配平该反应后,H+的系数是16
7.下列各项中的两个量,其比值一定为2:1的是
A.在反应2FeCl3+Fe=3FeCl2中氧化剂与还原剂的物质的量之比
B.相同温度下,0.2mol·L-1CH3COOH溶液与0.1mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2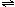 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积
6.很多物质的名称中含有水,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的“水”不是以上三种含义的是
A.重水 B.溴水 C.水银 D.水晶
5.红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯组成,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是
A.Mg B.Sr C.K D.Cl
4.下列七种试剂中:①酚酞试液 ②银氨溶液 ③稀H2SO4 ④Na2SO3溶液 ⑤FeCl3溶液(加少量HCl) ⑥石灰水 ⑦Na2CO3溶液 都不宜长期放置的组合是
A.②④⑥ B.①②④⑥⑦
C.②③⑤⑦ D.②④⑤
3.下列说法正确的是
①合金的硬度一般比它的各成分金属的小,熔点一般比它的各成分金属的高;
②SiC俗称金刚砂,可用作砂纸、砂轮的磨料;
③漂白粉和漂白精的有效成分都是Ca(ClO)2;
④NO在人体的血管系统内具有传送信号的功能,也是大气污染物之一;
⑤氧化铜可作为制造玻璃、搪瓷的红色颜料。
A.①③⑤ B.②③④ C.①②⑤ D.②③⑤
2.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,己知硫化羰的结构与二氧化碳相似,但能在氧气中完全燃烧,下列有关硫化羰的说法中正确的是
A.硫化羰是酸性氧化物
B.硫化羰是由极性键构成的非极性分子
C.硫化羰可用做灭火剂
D.硫化羰在氧气中完全燃烧后的生成物是CO2和SO2
23.工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
_____Cr2O72-+_____Fe2++_____H+ --_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。 (2)计算工业甲醇的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com