
题目列表(包括答案和解析)
19.(7分)为分析县城的空气质量情况,校化学研究性学习小组的同学拟测定县城上空空气中SO2的含量并制定了下列研究方案:
Ⅰ.相关文献调研:了解空气中主要污染指标,其中SO2对人体有哪些危害;了解SO2的化学性质,为测定SO2的含量寻找理论依据[资料表明,SO2具有较强的还原性,能与酸性KMnO4溶液(紫色,其还原产物Mn2+在水溶液中接近无色)发生如下反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+]。
Ⅱ.设计实验方案:
方案一:利用SO2能使品红溶液褪色的原理进行半定量分析;
方案二:利用SO2的还原性进行定量分析。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
请你参与该研究性学习小组的活动并发表你的见解:
⑴ 如果利用方案一对空气中SO2的含量半定量分析,你建议配制的品红溶液的浓度 (选填“宜大不宜小”、“宜小不宜大”或“大小均可”);
⑵ 该小组的同学拟用下列装置通过方案二定量分析空气中SO2的含量:

①通入空气前应进行的实验操作是 ;
② 当看到 现象时,应停止通空气;
实验过程中需测量并记录的数据: 。
⑶ 下图是该小组同学根据实验测得的县城不同地区空气中SO2含量:
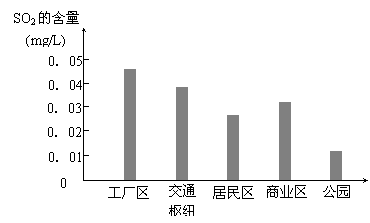
① 工厂区、交通枢纽SO2含量明显高于其他地区的原因是 ;
② 请你向当地有关部门提出一条减少工厂区SO2排放的建议 ;
⑷ 下表是该小组同学测得的不同天气情况下的县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因 。
|
天气情况 |
平均风速(m/s) |
空气中SO2的平均含量(mg/L) |
|
雨 前 |
2.0 |
0.03 |
|
雨 后 |
2.2 |
0.01 |
|
晴 |
23 |
0.015 |
|
晴 |
0.9 |
0.03 |
18.(12分)下图是元素周期表中的前四周期,回答下列问题:
|
① |
|
|
|||||||||||||||
|
|
② |
|
③ |
④ |
⑤ |
|
⑥ |
|
|||||||||
|
|
|
|
|
⑦ |
|
|
|
||||||||||
|
⑧ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴按原子轨道的重迭方式,①与④形成的化合物中的共价键属于 键。
⑵②、⑤、⑥、⑧4种元素第一电离能由高到低的顺序是 (用元素符号表示)。
⑶元素④形成的单质的晶体类型可以是原子晶体如 (填写物质名称),也可以是 如C60。
⑷元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这2种化合物分子的立体结构明显不同。③、⑥2种元素形成的化合物分子的立体结构为 ,⑦的氢化物分子的立体结构为 。
17.(10分)胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3-4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
⑴根据所学知识,请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
⑵试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
⑶试写出乙中含有的主要化学成份和氢氧化钠溶液反应的离子方程式:
。
⑷在两支装有浑浊水(混有少量泥沙)的试管中,分别加入少量乙的主要成份和少量的硫酸铁,静置一段时间,两试管中水均变得澄清透明。请以硫酸铁为例用离子方程式说明产生此现象的原因: 。
16.(14分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , 。
⑵该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
⑶该药品须密封保存,若表面出现颜色变化,说明部分+2价铁已变成+3价铁。请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 。
15.(8分)化学课上,某班同学围绕硫酸及其盐的性质进行如下探究,请你填写有关答案。
⑴取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是 (填化学式)。溶液中同时有蓝色沉淀 (填化学式)生成。
⑵“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)。
。
14.按下图装置,持续通入过量X气体,可以看到a处有红色物质生成,b处变蓝,在c处点燃可看到淡蓝色火焰或蓝色火焰,则X气体可能是 ( )
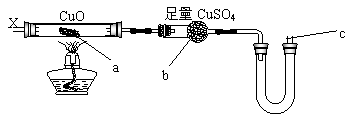
A.H2 B.CO C.Cl2 D.CH3CH2OH(气)
第二卷(非选择题 共72分)
13.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ca2+
12.下列离子方程式书写正确的是 ( )
A.用大理石和稀盐酸制取二氧化碳:2H+ +CO32-=CO2 ↑+H2O
B.钠投入水中:Na+H2O=Na++OH-+H2 ↑
C.向AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+ SO2+ H2O = HClO+ HSO3-
11.以下物质间的每步转化通过一步反应能实现的是
A.Al-Al2O3-Al(OH)3-NaAlO2 B.Fe-FeCl2-Fe(OH)2-Fe(OH)3
C.S-SO3-H2SO4-MgSO4 D.N2-NO-NO2-HNO3
10.对经常出现的客观现象进行归纳可以形成相应规律,但客观事物有时也会有违背普遍规律的现象,寻找例外现象出现的原因正是科学发展的内在动力。下列事实与相关规律不相吻合并有其内在原因的是 ( )
A.Cs是很活泼的金属 B.I2易溶于四氯化碳
C.HF在标准状况下是液体 D.Cl在第三周期中原子半径最小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com