
题目列表(包括答案和解析)
5、下列叙述正确的是
A. 48gO3气体含有6.02×1023个O3分子
B. 常温常压下,46gNO2气体含有6.02×1023个NO2分子
C. 1L 0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D. 标准状况下,33.6LH2O含有9.03×1023个H2O分子
4、下列关于盐的反应规律的说法中不正确的是
①盐和酸反应一定生成另一种盐和另一种酸②盐和碱反应一定生成另一种盐和另一种碱③两种盐反应一定生成另外两种盐 ④阳离子相同的两种盐一定不能发生反应
A.只有② B.只有③ C.只有①④ D.①②③④
3、据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵的物质。下列说法正确的是
A.N5和N2互为同位素 B.18O2的摩尔质量为36
C.原子半径:N<18O D.2N5 = 5N2是化学变化
2、2004年化学元素家族又添新成员:113号元素Uut和115号元素Uup。已知113号元素的一种核素为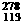 Uut,下列说法中正确的是
Uut,下列说法中正确的是
A.113号元素的相对原子质量为278 B.115号元素可显+3和+5价
C.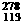 Uut的中子数与电子数之差为165
D.两种元素均位于周期表第八周期
Uut的中子数与电子数之差为165
D.两种元素均位于周期表第八周期
1、门窗紧闭的厨房内一旦发生煤气大量泄漏,极容易发生爆炸。当你从室外进入厨房嗅到极浓的煤气异味时,在下列操作中,你认为最合适的是
A.立即开启抽油烟机排出煤气,关闭煤气源 B.立即打开门和窗,关闭煤气源
C.立即打开电灯,寻找泄漏处 D.上述三者可同时进行
24.(8分)现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末(反应为:2Na2O2+2CO2=2Na2CO3+O2),结果过氧化钠粉末增重0.336g。
⑴通过计算确定M2CO3的M为何种元素。
⑵有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?

命 题:朱时来 审 核:顾建新 校 对:顾建新
23.(7分)2007年3月8日媒体报道了陕西肯德基连锁店在煎炸油中添加滤油粉的情况,经卫生部门检测滤油粉实质为食品级三硅酸镁。三硅酸镁为白色无味粉末,不溶于水和乙醇,易与无机酸反应。某化学兴趣小组测定三硅酸镁的化学式(可用MgxSi3Oy·mH2O表示)。实验步骤如下:
步骤一:取16.6 g三硅酸镁样品,充分加热至不再分解为止,冷却、称量,得固体13.0 g。
步骤二:另取16.6g三硅酸镁搅拌中加足量4 mol/L盐酸100 mL,充分反应后,过滤,洗涤,烘干得固体9.0 g。该固体为空间网状结构且熔沸点很高。有关部门规定三硅酸镁样品中含水量12.2 %为优良级。
则:(1)计算确定MgxSi3Oy·mH2O的化学式。
(2)该小组测定的三硅酸镁样品是否为优良级?
(3)写出该三硅酸镁样品与盐酸反应的化学方程式。
22. (12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
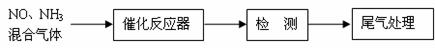
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C
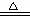 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
21.(4分)不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n (n = 1,3,5,7;且非金属性X′>X)。卤素互化物大多为强氧化剂。回答下列问题:
(1)卤素互化物中,沸点最低的应是 (写分子式,下同)。
(2)若n = 7,则最可能生成的卤素互化物应为 。
(3)某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,则n的值为 。
20.(12分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
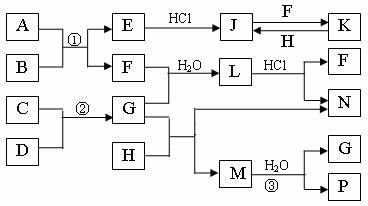
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
⑴化合物A中含有的两种元素是 。
⑵F的化学式 ;G的水溶液中,最多的阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com