
题目列表(包括答案和解析)
9.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.K+、Ba2+、OH-、SO42- B.Ag+、NO3-、Cl-、K+
C.H3O+、NO3-、Fe2+、Na+ D.Cu2+、NH4+、Br-、OH-
|
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ·mol-1,反应物总能量>生成物总能量
B.CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ·mol-1反应物总能量>生成物总能量
C.101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ·mol-1,H2燃烧热的571.6 kJ·mol
D.H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,含1mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
8.在SiO2+3C SiC+2CO↑的反应中,氧化剂和还原剂的质量比为 ( )
A.5:3 B.1:2 C.2:1 D.7:6
7.下列物质中,化学式能准确表示该物质分子组成的是 ( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2)
C.葡萄糖(C6H12O6) D.碳化钙(CaC2)
6.已知蓄电池在充电时作电解池,放电时作原电池;铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”;关于标有“-”的接线柱,下列说法正确的是 ( )
A.充电时作阴极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阳极,放电时作正极
5.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是 ( )
A.氯化钠和蔗糖的熔化 B.镁和硫的熔化
C.二氧化硅和氧化镁的熔化 D.碘和干冰的升华
4.有关各种分散系的说法中,正确的是 ( )
A.直径介于1-100m之间的微粒称为胶体
B.某些胶体带电,可以发生电泳现象
C.通直流电后,溶液中溶质粒子分别向两极运动,胶体中分散质粒子向某一极运动
D.可以利用丁达尔效应鉴别胶体和溶液
3.下列说法正确的是 ( )
A.由于浓硝酸具有强氧化性,所以在溶液中NO3-与S2-两者不可大量共存
B.完全由非金属元素组成的化合物,一定是共价化合物
C.在书写离子方程式时,弱电解质一定不能拆成离子形式
D.由于纯水几乎不导电,所以水是非电解质
2.下列离子方程式正确的是 ( )
A.Ca(OH)2溶液吸收过量的CO2:OH-+CO2=HCO3-
B.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.锌与6mol/L HNO3溶液反应:Zn+2H+=Zn2++H2↑
D.苯酚钠溶液中通入足量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
1.下列说法正确的是 ( )
A.氢键是一种特殊的化学键 B.分子晶体中一定存在共价键
C.离子晶体在常温下均为固态 D.原子晶体中不一定存在共价键
|
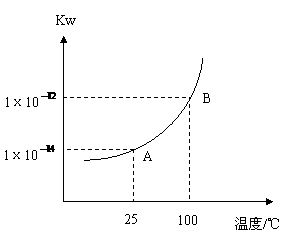
21.水的电离平衡曲线如右图所示: (1)若A、B两点分行分别表示25 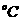 时、100 时、100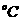 时水的离子积,,造成水的离子积增大的原因是: 时水的离子积,,造成水的离子积增大的原因是:。 |
 |
(2)100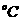 时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所有得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所有得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(3)100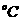 时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
。
时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com