
题目列表(包括答案和解析)
6.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤ C.①②④ D.②③④⑤
5.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
,下列叙述正确的是
4NO(g)+6H2O(g)
,下列叙述正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v正(NH3)=3v正(H2O)
4.下列操作或仪器的选用正确的是
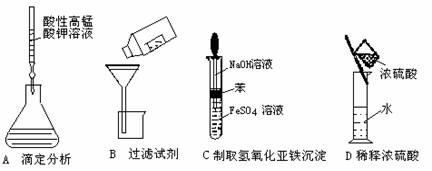
3.下列化合物中,不能通过化合反应而得到的是
A.NH3 B.Fe(OH)3 C.FeCl3 D.Al(OH)3
2.下列过程属于化学变化的是:①白色的硫酸铜粉末久置于空气中变成蓝色;②福尔马林用来浸制标本;③同素异形体之间的互变;④同分异构体之间的互变;⑤蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦;⑥氯化钠溶液通电后导电
A.只有①②④⑤ B.只有①④⑤ C.只有①②③④⑤ D.全部
1.金属钠不仅跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
25.(6分)化学反应常伴随热量变化,即反应热。反应热分为燃烧热、中和热、沉淀热等多
种形式。中和热测定提供了一种测定反应热的方法,是一个重要的定量实验。该实验步骤为:①制作量热计;②量取50mL 0.50mol/L盐酸并测定初始温度;③量取50mL 0.50mol/L NaOH溶液并测定初始温度;④混合酸碱溶液,搅拌,测混合液最高温度;⑤重复②③④三步骤;⑥数据处理:计算中和热。(中和后生成的溶液的比热容C=4.18J·g-1·℃-1,溶液密度为1g/mL)某学生做此实验数据如下:
|
实验次数 |
初始温度t1/℃ |
混合液最高温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
19.9 |
20.0 |
23.5 |
|
2 |
20.0 |
20.1 |
23.7 |
(1)计算中和热△H= 。
(2)中和热的理论值为△H=-57.3kJ/mol,造成该实验误差的原因可能是
A.小烧杯口高于大烧杯口 B.整个过程动作慢了
C.用环形铁制搅拌棒代替玻璃搅拌棒 D.可能存在稀释热
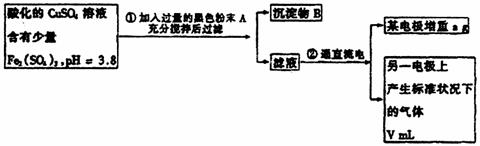 26.(15分)已知pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量,其实验流程如下图所示:
26.(15分)已知pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量,其实验流程如下图所示:
试回答下列问题:
(1)步骤①所加入的A的化学式及加入A的作用是 (填字母);
a. Fe2O3;抑制Fe3+水解
b. CuO;与H+反应,调节溶液pH在4-5间使Fe3+完全水解
 c.
CuO;与Fe2(SO4)3发生氧化还原反应
c.
CuO;与Fe2(SO4)3发生氧化还原反应
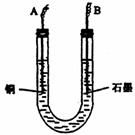
(2)步骤②中所用部分仪器如图所示:则A应接直流电源
的 极。B电极上发生的电极反应式为
。
(3)在确定电极质量增生a g的操作中,下列实验操作属于不
必要的是 (填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.低温烘干电极后称量
E.再次低温烘干后称量至恒重
(4)电解后向溶液中加入石蕊试液,观察到的现象是 。
(5)铜的相对质量的计算式为 。
(6)步骤②的变化中,从能量转化的角度看是 能转化为 能。
24.(12分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中
燃烧的产物可使品红溶液褪色。把Z的氯化物的饱和溶液滴入沸水中可得到红褐色液体,且该液体具有丁达尔效应。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)请写出“Z的氯化物的饱和溶液滴入沸水中可得到红褐色液体”这个反应的离子方程式 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V形成的10电子氢化物中,沸点较低的是(填化学式) ;
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 。
由此可知VW和YW2还原性较强的是(填化学式) 。
23.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温氮气流中,通
|
SiO2+ C+ N2 Si3N4+ CO
(1)配平上述方程式。
(2)该反应的氧化剂是 (填化学式);被1mol氧化剂氧化的还原剂的物质的量为 mol。
(3)氮化硅硬度大,熔点高,属于 (填晶体类型)晶体;将下列物质熔点由高到低排序:①单晶硅;②N2;③氮化硅;④C60 (填序号)。
22.(6分)按要求写方程式
①向氢氧化钡溶液中逐滴滴入硫到氢钠溶液,至钡离子完全沉淀。写出此反应的化学方程式 。
②向上述所得溶液中继续滴加硫酸氢钠溶液。写出此时溶液中反应的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com