
题目列表(包括答案和解析)
3.把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是
(A)0.5摩/升 (B)0.1摩/升 (C)0.05摩/升 (D)1摩/升
[91全国]
2.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大的是:
(A)自来水 (B)0.5摩/升盐酸
(C)0.5摩/升醋酸 (D)0.5摩/升氯化铵溶液
1.下列说法正确的是
(A)酸式盐的溶液一定显碱性
(B)只要酸与碱的摩尔浓度和体积分别相等,它们反应后的溶液就呈中性
(C)纯水呈中性是因为水中氢离子摩尔浓度和氢氧根离子摩尔浓度相等
(D)碳酸溶液中氢离子摩尔浓度是碳酸根离子摩尔浓度的二倍
27.(10分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为正整数,且2<b<6,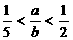 ),有的还含一定数目的结晶水,其组成随反应条件不同而异。
),有的还含一定数目的结晶水,其组成随反应条件不同而异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH2O(c也是正整数),已知a+b+c=9。取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P2O5的U型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水的碱式硫酸铜的化学组成。
26. (7分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(7分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.5mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
25.(10分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:
RX+Mg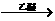 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
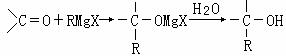
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。

请按要求填空:
(1)F的结构简式是 ;
(2)C+D→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。
24.(8分)已知四种丁醇在催化剂存在下跟空气反应的情况如下:
 (1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(2)各种戊醇在这样条件下,可能得到多少种醛,请写出其结构简式 。
(3)始终不反应的戊醇的结构简式是 。
23.(10分) 下图中的每1方格表示有关的一种反应物或生成物。其中A、C为无色体。

完成下列问题:
(1)物质M可以是 或 ,C是 ,F是 。
(2)淡黄色粉末的电子式是:
(3)反应①的化学方程式:
(4)反应②的离子方程式: 。
22.(11分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10。B和D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18。A、B、D能形成一种离子化合物,其水溶液是酸性。请写出:
(1)C的元素符号____________,X跟Y反应的化学方程式___________________________。
(2)用离子方程式解释A、B、D形成的化合物水溶液呈酸性的原因是
_____________________________________________________________。
(3)铋(Bi)跟Cl元素能形成化合物(BiCl3),其水解生成难溶于水的(BiOCl)。BiCl3水解反应的化学方程式为__________________________________。
(4)把适量的BiCl3溶于含有少量Y的水中,能得到的澄清溶液,试分析可能的原因
______________________________________________________________________________。
(5)医药上把BiOCl叫做“次某酸铋”,分析这种叫法的不合理之处。
_____________________________________________________________。
21.(8分) “过氧乙酸”是抗“非典”中广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品标签:
|
过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式CH3COOH+ H2O2→CH3COOOH + H2O。 CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成份。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
① 提出假设:甲溶液的主要成分为
乙溶液的主要成分为 。
②实验验证:取甲、乙两种溶液少许,分别加入几滴 试液,甲溶液的现象为 ,乙溶液的现象为 。
③得出结论:甲溶液的主要成分为
乙溶液的主要成分为 。
(2)该校根据“非典”消毒要求,急需配制0.2%过氧乙酸消毒液1m3,需要购进甲溶液_________瓶,乙溶液____________瓶。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com