
题目列表(包括答案和解析)
1.2001年美国的IBM公司制造出纳米碳晶体管,下面有关纳米碳的说法正确的是
A.纳米碳是一种新型高分子化合物 B.纳米碳的化学性质很稳定
C.纳米碳的结构和化学性质与金刚石相同 D.纳米碳的导电过程属于化学变化
25、(6分)将两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是多少毫克?
24、(3分)加热3.24g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为2.51g。计算原混合物中碳酸钠的质量分数。
23、(9分)实验室为准确测定某盐酸的浓度,通常采用无水苏打(Na2CO3)配成的标准液滴定。其操作是:称取W克纯净无水苏打,放入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
⑴ 锥形瓶应加2-3滴指示剂X,因CO2溶于其间会影响pH值,为了结果的准确性, 滴定终点的pH宜选在4-5之间,那么在常见的几种指示剂中宜选用的X是 ,当滴定至溶液颜色由 色变为 色时即表示达到了滴定终点。
⑵ 若滴定终点时,W克苏打消耗盐酸VmL,则盐酸物质的量浓度为
⑶ 若称取的W克无水苏打不纯,则所测盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol·L-1,滴定时测得盐酸浓度为C2mol·L-1,下列情况下C1与C2的关系是:(填上 >、< 或 = )
① 若苏打中含有小苏打,则C1 C2 ② 若苏打中含有苛性钠,则C1 C2
③ 若苏打中含有结晶水,则C1 C2 ④ 苏打中含有少量食盐,则C1 C2
22、(12分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为: 。
利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
|
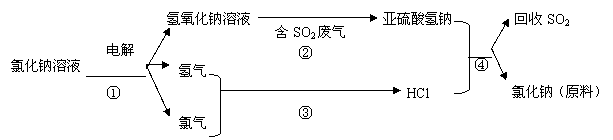
写出②④的化学反应方程式:
⑸ 上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
21、(6分)含有农药、染料、酚、氰化物,以及有色、有臭味的废水,常用化学氧化法进行处理。所用的氧化剂有氯类(如液氯、漂白粉、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-离子)的废水。在碱性条件下(pH为8.5-11),氯气可将氰化物中CN-氧化为比它毒性小1000倍的氰酸盐(含CNO-)。
(1)写出含CN-废水中用氯气氧化,生成氰酸盐的离子方程式 。
(2)若在含CNO-的废水中再通入氯气可使CNO-转化为无毒的气体等,写出这个反应的离子方程式 。
(3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为 。
19、(10分)利用下列氧化还原反应:Zn+ Hg2+= Hg+ Zn2+,设计一个锌-汞原电池,要求:(1)画出原电池的装置图,注明电极材料和电解质溶液。
(2)写出电池的电极反应式和总反应式。
20、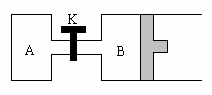 (8分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:
(8分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:
2X(g)+2Y(g)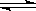 Z(g)+2W(g);ΔH<0,
Z(g)+2W(g);ΔH<0,
达到平衡Ⅰ时,V(B)=0.8a L。
请计算:
⑴B中X的转化率α(X)=
⑵B中Z和A中W的物质的量比较:n(Z)B n(W)A
(选填:“>”、“<”或“=”);原因是 (限30个字内)。
⑶打开K,过一段时间重新达到平衡Ⅱ时,B的体积是 L(用含a的代数式表示,连通管中气体体积忽略不计)。
18、等浓度等体积的NaCl、NaAc、Na2S溶液中阴离子的物质的量的分别为amol、bmol、cmol。则a、b、c的大小关系为( )
A、a=b=c B、c>a>b C、a=b>c D、c>b>a
17、标况下,aLCO2气体通过足量Na2O2所得气体与bLNO混合时,可得cL气体,以下表达式错误的是( )
A、若a<b,则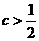 (a+b) B、若a<b,则
(a+b) B、若a<b,则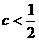 (a+b)
C、若a>b,则
(a+b)
C、若a>b,则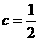 (a+b) D、若a=b,则
(a+b) D、若a=b,则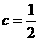 (a+b)
(a+b)
16、取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是 ( )
A、混合溶液中由水电离出的c(OH¯)小于0.2mol·L-1HX溶液中由水电离出的c(H+)
B、c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C、c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D、c(OH¯) = c(H+)+c(HX) = 1×10-8mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com