
题目列表(包括答案和解析)
5.在3NO2+H2O==2HNO3+NO反应中, NO2( )
A. 是氧化剂 B. 是还原剂 C.既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
4.胶体区别于其他分散系的本质特征是( )
A.胶体粒子大小在1nm-100nm之间 B.胶体粒子可透过滤纸
C.胶体粒子不能透过半透膜
D.光束穿过胶体时形成一条光亮的通路
3.下列叙述正确的是( )
A.原子晶体中只含共价键 B.离子晶体中只含离子键
C. 分子晶体中只存在分子间作用力,不含其他化学键
D.任何晶体中若含有阳离子也一定含有阴离子
2.下列各物质的晶体中晶体类型相同的是( )
A.NaBr和HBr B.Cl2和KCl C.CO2和H2O D.CCl4和NaCl
1.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是
A.碘和干冰的升华 B.氯化钠和蔗糖的熔化
C.镁和硫的熔化 D.氧化钠和二氧化硅的熔化
28.(18分)某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品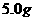 ,并溶于蒸馏水。
,并溶于蒸馏水。
② 。
③过滤。
④ 。
⑤将沉淀烘干、称量,测得固体质量为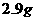 。
。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器有 。
②检验沉淀是否洗净的方法是 。
③烘干沉淀应采取的方法是
A、低温烘干 B、高温烘干 C、利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量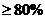 ,
,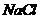 含量
含量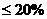 ,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
27. (12分) 27.(12分)若不考虑空气等因素的影响,试计算:
(1)将10g铁粉加入到50mL 2mol·L-1的稀硫酸中,充分反应后生成硫酸亚铁的物质的量为 。
(2)将ag生铁(成分是Fe和C)加入到b mL 2 mol·L-1的稀硫酸中,充分反应后生成氢气c L(标准状况),溶液中有黑色固体剩余。再加入少量稀硫酸,黑色固体不溶解,则生铁中Fe的质量分数是 (用代数式表示)。
(3)将ag处理过的废铁屑(成分是Fe和Fe2O3)加入到b mL 2mol·L-1的稀硫酸中,生成氢气c L(标准状况)。充分反应后生成硫酸亚铁的物质的量取值范围为:
<n(FeSO4)≤ (用代数式表示)。
26.(18分)下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
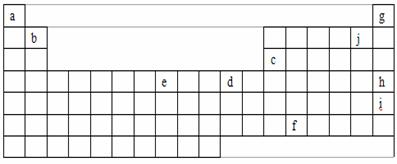
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_________,其原因是__________________________________。
(2)e是周期表中的_________族元素,最外层电子数为_______。
(3)a的阴离子半径____b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)_______________ ______;______________________ ______。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为______________________________________。
(6)元素周期表第6周期中的镧系元素共有 种,它们原子的电子层结构和性质十分相似。
13.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:
 Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是( )
Ca(OH)2(s) Ca2+(aq)+2OH-(aq)下列说法正确的是( )
A.恒温下向溶液中加Ca(OH)2,溶液的pH升高
B. 给溶液加热,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,其中固体质量增加
D. 向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com