
题目列表(包括答案和解析)
28.(6分)现有原子序数依次增大的A、B、C、D、E五种短周期元素。已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水。请回答:
(1)B元素在元素周期表中的位置是 。
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是 (填化学式)。
(3)写出A、C两元素的最高价氧化物的水化物之间反应的离子方程式:
。
(4)将A元素的一种氧化物11.7 g与足量二氧化碳完全反应,有 mol 电子发生转移。
27.(6分)恒压(1.01×105Pa)下,将2molSO2与a mol O2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
 2SO2(g)+O2(g) 2SO3(g),△H<0
2SO2(g)+O2(g) 2SO3(g),△H<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,
则a= ;平衡时SO2的转化率为 。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。T1与T2的关系是
(选填序号)
①T1>T2 ②T1<T2 ③T1=T2
26. (9分)(1)实验室若配制浓度较大的碘水,一般是将I2溶于KI溶液中,原因是发生了如下反应: I2(aq)+I-
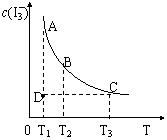
(9分)(1)实验室若配制浓度较大的碘水,一般是将I2溶于KI溶液中,原因是发生了如下反应: I2(aq)+I- -3。由于c(-3) 远大于c(I2) ,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,-3 的物质的量浓度c(-3)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
-3。由于c(-3) 远大于c(I2) ,所以该溶液的颜色较单纯的碘水更深。上述平衡体系中,-3 的物质的量浓度c(-3)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。
①A状态与C状态的化学反应速率υ (A) υ(C)。
②D点所示状态,υ(正) υ(逆) 。
(2)高炉炼铁中发生的基本反应之一为:FeO+CO Fe+CO2
△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
Fe+CO2
△H>0,其平衡常数可表示为K=c(CO2)/c(CO),已知1373K时K=0.263。
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)
②1373K时测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
25.(6分)下表是元素周期表的一部分。表中所列的字母分别代表某一元素。
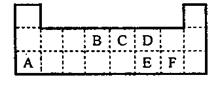
(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。
(2)写出B的最高价氧化物的电子式 。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化

其中化合物M是一种白色胶状沉淀,则M为(填化学式) ;
K的溶液与B的某种氧化物反应的化学方程式为 ;
一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
24. (6分)如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物。按要求回答下列问题:
(6分)如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物。按要求回答下列问题:
(1)E在元素周期表中位于第 周期;第 族
(2)写出A和B反应的化学方程式: 。
(3)C和E反应的化学反应方程式为
23.(6分)某研究性学习小组对铝热反应实验展开研究。教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
22.将一定量Na2O、Na2O2、Al组成的混合物投入足量水中,再滴加2 mol·L H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为
H2SO4100mL时产生沉淀最多,则混合物中Na2O和Na2O2的总物质的量为
A.无法确定 B.0.2mol C.0.4mol D.0.5mol
高三化学上学期期中质量检测试题
高三化学试题
第Ⅱ卷(共56分)
21.Fe3O4粉末能与稀硝酸反应生成硝酸铁和一种无色气体A,气体A在空气中很快变成红棕色。当有116g的Fe3O4溶解时,被还原的HNO3的物质的量为
A.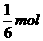 B.
B.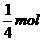 C.
C. D.
D.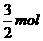
20.在一固定体积的密闭容器中,有下列化学反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
其化学平衡常数K和温度T的关系如下表:
|
T(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
则下列有关的叙述正确的是
A.该反应正向反应为放热反应
B.在温度升高平衡移动的过程中气体压强始终保持不变
C.若绝热时(容器内外没有热量交换),平衡移动的结果使二氧化碳的浓度增大,则容器内气体的温度一定升高
D.若在某平衡状态时,c(CO2)× c(H2)= c(CO)×c(H2O),则此时的温度为830℃
19.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列说法正确的是
A.离子半径大小:r(M3+)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com