
题目列表(包括答案和解析)
20.(10分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
①称取0.271g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6mL。
②另取0.271g样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0700mol/L KMnO4溶液滴定,共用去20.0mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
⑴计算0.271g样品中的CaO2的物质的量。
⑵计算样品中的CaO2·xH2O的x值。
19.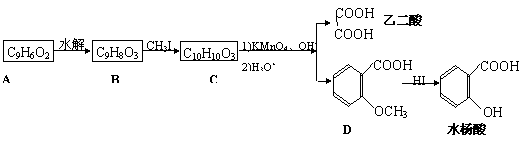 (10分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
(10分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
 提示:
提示:
①CH3CH===CHCH2CH3 CH3COOH+CH3CH2COOH
 ②R-CH=CH2
R-CH2-CH2-Br
②R-CH=CH2
R-CH2-CH2-Br
请回答下列问题:
(1)写出化合物C的结构简式_______________。
 (2)写出A B的化学方程式
(2)写出A B的化学方程式
(3)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。写出符合条件的所有同分异构体
。
(4)在上述转化过程中,反应步骤B→C的目的是_______________。
18.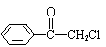 (9分)
(9分)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如右图所示:
则苯氯乙酮不可能具有的化学性质是 (填字母序号)
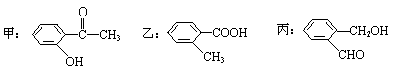 A、加成反应 B、取代反应 C、消去反应 D、水解反应 E、银镜反应
A、加成反应 B、取代反应 C、消去反应 D、水解反应 E、银镜反应
(2)今有化合物
①请写出丙中含氧官能团的名称
②请判别上述哪些化合物互为同分异构体:
③请按酸性由强至弱排列甲、乙、丙的顺序:
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
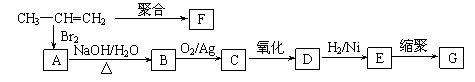
①丙烯分子中,最多有 个原子在同一个平面上;
②聚合物F的结构简式是 ;
③写出一定条件下,E生成G的化学方程式 。
17.(10分)已知甲和I、L、M均为常见的单质,I在常温下为气体,L、M为金属;气体K的水溶液显碱性;A是由前20号元素组成的阴阳离子个数比为1:1的离子化合物,且阴离子含有14个电子;乙是一种红棕色的粉未,G为白色胶状沉淀,D在常温下是无色液体,C的溶液常用于在实验室检验E。各物质之间的转化关系如下图所示(部分物质在图中没有列出)。
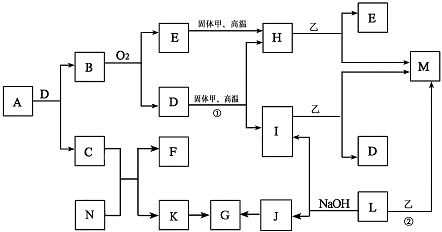
请根据要求填空:
(1)A的化学式 ,E的电子式 。
(2)反应①的化学方程式 。
(3)反应②的化学方程式 。
(4)J→G的离子方程式 。
16.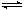 (12分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(12分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
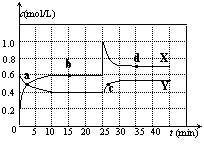 (1)图中共有两条曲线X和Y,其中曲线 表示NO2
(1)图中共有两条曲线X和Y,其中曲线 表示NO2
浓度随时间的变化;a、b、c、d四个点中,表示化学反应处
于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率
v(NO2)=
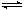 ②15min时,反应2NO2(g) N2O4(g)在b点的浓度
②15min时,反应2NO2(g) N2O4(g)在b点的浓度
平衡常数K(b)=
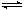 ③35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d)
K(b)
③35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d)
K(b)
(填“>”、“=”或“<”)
(3)①若要达到使NO2(s)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小玻璃容器的体积至1L,气体的颜色变化过程是 。
15.(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是 。
(3)下图为常见仪器的部分结构(有的仪器被放大)
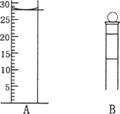
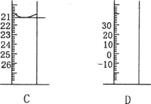
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填字母标号)。
14、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
13.以下离子检验的结论可靠的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B. 通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I-
C. 往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32-
D.往溶液中加入 BaC12溶液和稀HNO3 ,有白色沉淀生成,说明有SO42-
12.下列离子方程式书写正确的是:
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:
3Ba2+ + 6OH– + 2Al3+ + 3SO42–== 3BaSO4↓+ 2Al(OH)3↓
B.向硝酸银溶液中加入过量氨水:Ag+ + 2NH3·H2O = [Ag(NH3)2]+ + 2H2O
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2+ + SO42– == BaSO4↓
D.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
11.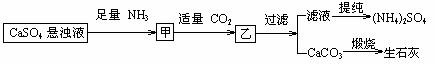 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com