
题目列表(包括答案和解析)
20、高温下2HBr(g)  H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.降低温度 B.缩小体积 C.减小压强 D. 增大Br2浓度
19、用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
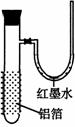 A. 实验中发生的反应都是氧化还原反应
A. 实验中发生的反应都是氧化还原反应
B. 铝是一种较活泼的金属,
C. 铝与氧气反应放出大量的热量
D. 铝片上生成的白毛是氧化铝和氧化汞的混合物
18、设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个
B. 14g乙烯和丙烯的混合物中总原子数为3NA个
C. 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D. 5.6g铁与足量的稀硫酸反应失去电子数为0.3NA个
17、三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A. 可用铁作阳极材料
B. 电解过程中阳极附近溶液的pH升高
C. 阳极反应方程式为: 2Cl- - 2e- = Cl2
D. 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
16、下列说法正确的是
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C. Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D. 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
15、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
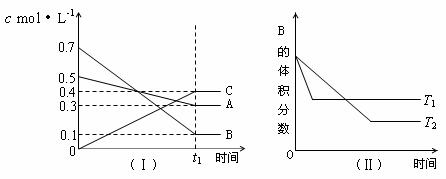
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
14、对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,平衡时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
13、在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g)  2NO2(g) △H>0
达平衡时NO的转化率与温度的关系如图,标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
2NO2(g) △H>0
达平衡时NO的转化率与温度的关系如图,标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
A.A或E B.B点
C.C点 D.D点
11、对于Zn(s)+H2SO4(l) = ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
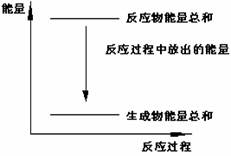 A.反应过程中能量关系可用右图表示
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
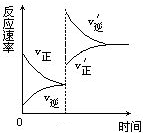 12对达到平衡状态的可逆反应X+Y
12对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为
A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C.X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体
10、在给定的四种溶液中,加入以下各种离子,各离子一定能在原溶液中大量共存的是
A.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-
B.pH为11的溶液:S2-、SO32-、SO42-、Na+
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.无色溶液:K+、CO32-、NO3-、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com