
题目列表(包括答案和解析)
5.下列叙述正确的是 ( )
A.直径介于1nm-100nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
4.某无色溶液与NH4HCO3作用能产生气体,此溶液中一定能大量共存的离子组是( )
A.C1-、Mg2+、Zn2+、SO42- B.Na+、Ba2+、N3-、SO42-
C.MnO4-、K+、C1-、SO42- D.K+、NO3-、SO42-、Na+
3.在一个固定容积的容器中,有可逆反应
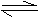 (Ⅰ)2A(g)+B(g) 2C(g);△H=+Q1kJ·mol-1
(Ⅰ)2A(g)+B(g) 2C(g);△H=+Q1kJ·mol-1
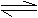 (Ⅱ)3A(g) D(g)+E(g);△H=-Q2kJ·mol-1
(Ⅱ)3A(g) D(g)+E(g);△H=-Q2kJ·mol-1
下列条件均能使反应(Ⅰ)、(Ⅱ)中的A的转化率增大的是 ( )
①增大压强 ②升高温度 ③增加A的浓度
A.仅① B.①③ C.①②③ D.都不能
2.随着人们生活节奏的加快,方便的小装食品已被广泛接受。为延长食品的保质期,防止
食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
1.为迎“绿色奥运”某同不提出了下列环保建意义,其中你认为可以采纳的是 ( )
①用气态燃料代替液态和固态燃料作为发动机动力来源
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发无磷洗涤剂
⑥提倡使用手帕,减少餐巾纸的使用
A.①②③④ B.②③④⑤ C.①②④⑤⑥ D.全部
35、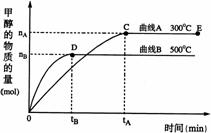 (10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)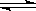 CH3OH(g) 。根据题意完成下列各题:
CH3OH(g) 。根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
36(12分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1) 硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为
________________________________ _______。
(2) 用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应
方程式(忽略氧的氧化还原)为 ___________________________________;该方法的优点是____________________________________。
(3) 一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p(NH3)×p(H2S) = a(Pa2),则容器中的总压为_____________Pa;
②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在\t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。

34、(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
33、(8分)“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A、<22.0s B、22.0~44.0s C、>44.0s D、数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
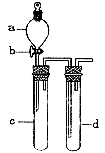
32、(12分)某兴趣小组设计右图所示装置来改进教材中“铜与硝酸反应”实验,
 以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是
.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的离子方程式是 。
以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是
.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的离子方程式是 。
再由a向c中加2 mL蒸馏水,c中的实验现象是 。 (3)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2
操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
31、(12分)实验室模拟合成氨和氨催化氧化的流程如下:
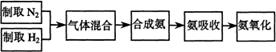 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

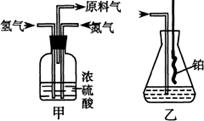
(1)从上图a、b、c中选择制取气体的合适装置:氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 (3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。 (4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。 (5)写出乙装置中氨催化氧化的化学方程式: (6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com