
题目列表(包括答案和解析)
17、(6分)实验室需要配制0.5mol·L-1的烧碱溶液500mL,根据溶液配制的过程,
回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其它玻璃
仪器有: ;
(2)根据计算得知,所需NaOH固体的质量为 g;
(3)配制溶液的过程中,有以下操作。其中正确的是 (填代号)。
A.将氢氧化钠固体放在纸片上称量;
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中;
C.将溶解氢氧化钠的烧杯中用蒸馏水洗涤2-3次,并将洗涤液转移到容量
瓶中。
(4)玻璃棒在该实验中的作用有:①
②
16、X、Y、Z三种短周期元素的原子具有相同的电子层,它们的最高价氧化物对应的水化物的酸性由弱到强的顺序是HXO3<H2YO4<HZO4 ,则下列说法正确的是
A.原子序数 X > Y > Z
B.元素的非金属性 X < Y < Z
C.气态氢化物的稳定性 H3X > H2Y > HZ
D.原子半径 X < Y < Z

 高三化学上学期复习班月考试题
高三化学上学期复习班月考试题
化 学
|
15、某元素在化学反应中,由化合态变成游离态,则下列说法正确的是
①该元素一定被氧化 ②该元素一定被还原 ③该元素可能被氧化,也可能被还原 ④元素化合价降为0 ⑤生成的单质为氧化产物 ⑥生成的单质为还原产物 ⑦生成的单质既可能为氧化产物也可能为还原产物 ⑧该过程不一定非得加氧化剂或还原剂才能实现 ⑨该反应不一定是放热反应 ⑩该反应一定不是复分解反应
A.③⑦⑧⑨⑩ B.①⑤⑩ C、②④⑥⑩ D、①②④⑤⑥
14、某液体分散系所表现出来的下列性质既可能是胶体所具有,也可能是溶液所具有的是
A. 光线透过时,从侧面可观察到一条光亮的通路
B. 加入适量稀H2SO4,产生沉淀
C. 分散质微粒直径小于1nm
D. 装入半透膜袋中并将其浸入盛水的烧杯中一段时间,结果袋外部有分散质微粒
13、下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO3- + Ca2+ + OH--= CaCO3↓ + H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:OH- +
NH4+ 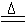
 H2O + NH3↑
H2O + NH3↑
C.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
D.单质铜与稀硝酸反应:Cu + 2H+ + 2NO3- = Cu2+ + 2NO↑ + H2O
12、下列物质:① Cl2 ② Na ③ Na2O2 ④ NO2分别与水反应,氧化剂与还原剂的物质的量之比为1:1的是
A.①② B.②③ C.①②③ D.①②③④
11、在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
10、某溶液含有① NO3- ② HCO3- ③ SO32- ④ CO32- ⑤ SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)
A.① B.①②④ C.①③⑤ D.①③④⑤
9、在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为
A.2mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
8、关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有C1-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,再加稀盐酸不溶解,可确定有SO42-存在
C.通入C12后,溶液变为黄色,加入淀粉溶液后变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com