
题目列表(包括答案和解析)
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构的分析正确的是 ( )
A.K3C60中既有离子键 ,又有极性键
B.1molK3C60中含有的离子数目为63×6.02×1023
C.该晶体熔融状态下能导电
D.该物质的化学式可定为KC20
5、我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液加入食盐ⅠA和食盐的饱和溶液通入足量气体BⅡ悬浊液过滤Ⅲ晶体Ⅳ纯碱
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
4、下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是 ( )
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
3.已知1g氢气燃烧生成气态水时放出120.9kJ的热量,1 mol液态水变成1 mol水蒸气时吸收44 kJ的热量,则表示氢气燃烧热的热化学方程式为
A.H2(g)+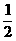 O2(g)=H2O(g);△H=-120.9kJ/mol
O2(g)=H2O(g);△H=-120.9kJ/mol
B.H2(g)+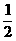 O2(g)=H2O(l);△H=-285.8 kJ/mol
O2(g)=H2O(l);△H=-285.8 kJ/mol
C.H2(g)+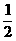 O2(g)=H2O(g);△H=-241.8kJ/mol
O2(g)=H2O(g);△H=-241.8kJ/mol
D.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
2、将纯水加热至90℃,下列叙述正确的是: ( )
A. 水的离子积变大、pH变小、呈酸性
B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性
D. 水的离子积变大、pH变小、呈中性
1.“在火星上找到水存在的证据”位居《Science》杂志评出的2004年10大科技突破之首。下列关于水的说法中错误的是
A.由于氢键的作用,使H2O的沸点及冰的密度出现反常
B.水是由极性键构成的极性分子
C.没有氢键,就没有生命,水是一切生命的基础
D.使用高效催化剂在较温和的条件下可使水分解,同时释放能量
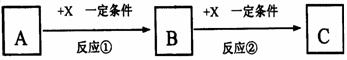
21、(10分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)
。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或 ,反应①的离子方程式为
或 。
20、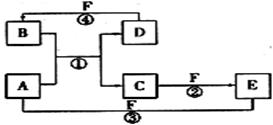 (14分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(14分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
( I ) 若A为常见的金属单质,D、F是气体且F的颜色为黄绿色,反应①在水溶液中进行。则: ①A、B分别为:A ,B (填化学式)。
②写出能够证明氧化性F>E的离子反应方程式为
( Ⅱ) 若A为短周期金属单质,D为短周期非金属单质,且所含的原子序数A是D的2倍,F的浓溶液与A、D反应都有红棕色气体G产生。则:
①A、B分别为:A 、B 。
②若将一充满m mL G和氧气混合气体的大试管倒立于水中,充分反应后,在相同
条件下测得试管中余下n mL气体,则原混合气体中G和氧气的体积分别为
19、(11分)现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为 、
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为 ;
(3)C单质与D的最高价氧化物的水化物反应的化学方程式为
写出C单质与二氧化锰在高温下反应的化学方程式,并标明电子转移的方向和数目。
(4)B跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为
18、(11分)一般测定样品中成分含量的实验应重复2-3次。为了测定某氢氧化钠固
体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
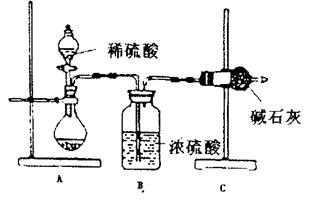
Ⅰ.甲同学的方案如上图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进
行 次;
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能的原因是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收;
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收;
D.加入稀硫酸的量不足
Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的
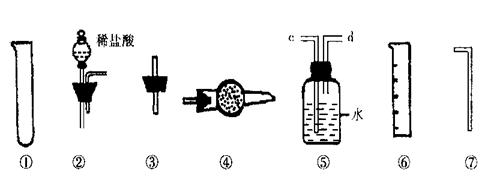 B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
(1)选择最简装置的连接顺序为 ;
(2)产生的气体从装置⑤的 端进入。
Ⅲ.丙同学的方案是:称取样品mg,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ;
(2)Ca2+、Ba2+都可以使CO32-沉淀完全。乙同学能否使用氯化钙溶液代替氯化钡溶液? 原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com