
题目列表(包括答案和解析)
24.(6分) 过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
① 称取0.270克样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6毫升。
② 另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液。化学方程式如下: 5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)计算样品中的CaO2的质量分数。
(2)计算样品中的CaO2·xH2O的x值。
23. (8分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(8分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(1)写出实验室制取A的化学方程式:___▲___;
(2)写出D→E的化学方程式:___▲___;
(3)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:___▲___;
(4)写出酯K的结构简式:___▲___。
22.(8分)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。请回答下列问题:

(1)指出反应的类型: 甲→丙:___▲___,甲→丁:___▲___。
(2)在甲~庚七种物质中,互为同分异构体的是___▲___(填代号,多选扣分,下同);
可看作酯类的是___▲___。
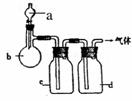
21.(8分)拟用如图装置制取表中的四种干燥、纯净的
气体(图中铁架台、铁夹、加热及气体收集装置均已
略去;必要时可以加热;a、b、c、d表示相应仪器中
加入的试剂)。
|
气体 |
a |
b |
c |
D |
|
CO2 |
盐酸 |
CaCO3 |
饱和Na2CO3溶液 |
浓硫酸 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥纯净的这种气体是___▲___
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体___▲___理由是___▲___;
②气体___▲___理由是___▲___;
③气体___▲___理由是___▲___;
④气体___▲___理由是___▲___。
20.(4分)下列有关实验说法错误的是___▲___
A.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.除去铝器皿表面的碳酸钙而不损伤铝器皿,可用冷的浓硫酸。
C.水中含有少量苯和硝基苯,可用活性碳吸附除去
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
E.检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-
 F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
19.(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是___▲___(填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是___▲___(填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是___▲___(填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 ▲ 。
18.(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
 反应Ⅰ HgS
+O2 Hg +SO2
反应Ⅰ HgS
+O2 Hg +SO2
 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是___▲___。
(2)请标出反应Ⅱ中电子转移的方向和数目___▲___。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式:___▲___。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+
 Hg22+ ,提高Hg22+浓度的方法是:___▲___。
Hg22+ ,提高Hg22+浓度的方法是:___▲___。
17.(6分)周期表中前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与D、B与E原子的电子层数都相差2。A、B原子最外层电子数之比为1∶4。A和D能以原子个 数比1∶1形成化合物。
(1)写出元素符号 A___▲___;B___▲___;D___▲___E___▲___。
(2)B与D形成的化合物是___▲___分子(填极性、非极性)。
(3)用电子式表示A和D形成化合物过程___▲___。
16. 可用于鉴别以下三种化合物的一组试剂是
可用于鉴别以下三种化合物的一组试剂是
乙酰水杨酸 丁香酚 肉桂酸
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
15.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)
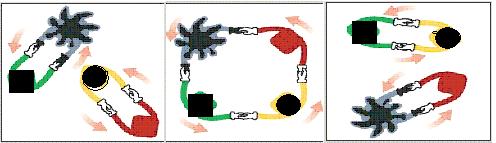
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两
对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列产物不可能存在的是
A.C6H5CH2CH==M B.CH2= CH2
C.C6H5CH2==CH2C6H5 D.C6H5CH2CH==CHCH2C6H5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com