
题目列表(包括答案和解析)
2.对于氨盐,下列叙述不正确的是 ( )
A.均易溶于水 B.均可与苛性碱反应
C.均为含离子键的共价化合物 D.受热分解有的发生氧化还原反应
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.加强工业用水净化系统工程的改造,提高水的重复利用率
29.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
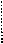 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。

(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
28. (10分)一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:
已知G的分子式为C10H22O3,试回答:
(1)写出B、E结构简式:_________ 、________;
(2)上述反应中属于取代反应的是___________(填序号);
(3)写出反应方程式:
I.反应② ;
Ⅱ.F与银氨溶液反应: 。
27.(9分)为测定某有机化合物A的结构,通过实验得出以下数据:
①将有机化合物A置于氧气流中充分燃烧,实验测得生成5.4gH2O和8.8gCO2。
②利用质谱仪测定出有机化合物A的相对分子质量为46。
③将9.2g该有机物与足量的金属钠反应,测得在标准状态下产生的氢气为2.24L。
请回答:
(1)有机化合物A中碳原子与氢原子的个数比是 ,A的分子式是 ,A的结构简式为 。
(2)化合物A在一定条件下脱水可生成B,B可合成包装塑料C。A转化为B的化学反应方程式为 ,反应类型为 。
(3)化合物A可在一定条件下通过粮食制得,由粮食制得的A在一定温度下密闭储存,由于发生一系列的化学变化而变得更醇香。在这一系列变化过程中,最后一步化学变化的化学方程式为 ,反应类型为 。
(4)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27oC)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,制备反应方程式为 ,反应类型为 。
26.(12分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
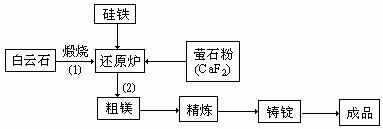
(1)在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”)理由是 。
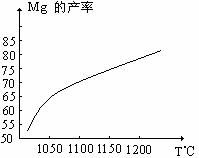
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 。
A.复盐 B.混合物 C.配合物
(4)写出煅烧白云石的反应化学方程式 。
25.(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式
__________________________________________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是________________________________________________________。
(4)一旦NF3泄漏,可以用 溶液喷淋的方法减少污染。
24.(10分)从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
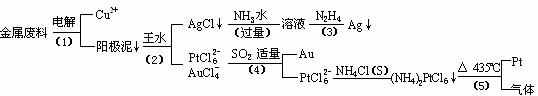
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式: 阳极: ,阴极: ;
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出。
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
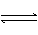 ;
;
(3)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
23.(12分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
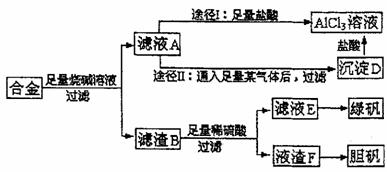
试回答下列问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式______________________;
(2)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为哪种途径比较合理,说明理由_________________________________________。
(3)从滤液E中得到绿矾的实验操作是_______________________________________。
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理,理由是________________________________。
(6)若上述方案所用的稀硫酸溶质质量分数为36.8%,那么100mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g。
22.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成。
。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色 |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①
② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
|
 (3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
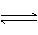 H2CO3
HCO3-+ H+
Ka1(H2CO3)=4.45×10-7
H2CO3
HCO3-+ H+
Ka1(H2CO3)=4.45×10-7
 HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
HClO H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com