
题目列表(包括答案和解析)
26.(9分)氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式: NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________________。
25.(10分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)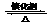 2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
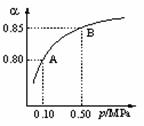
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
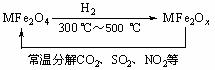
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
24.(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3 ;
;
Al2O3+Na2CO3 。
。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程式
23. (12分)下面是关于硫化氢的部分文献资料
(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。

实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应______ _____________________________
_______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
22.(10分)铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为 ,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) _______。
21.(7分)(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是______________________.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是________.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
20. 4.下列实验装置图完全正确的是
4.下列实验装置图完全正确的是
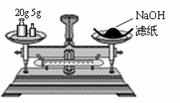
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
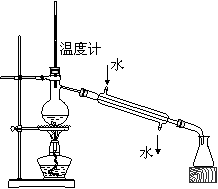
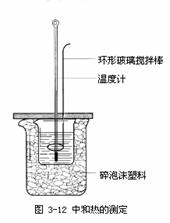
C.测定中和热 D.分离苯和甲苯
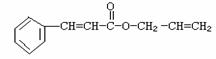
19.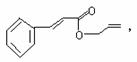 对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
 可简化为
可简化为
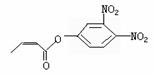
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生反应 D.均能与NaOH溶液发生反应
18. 已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×
10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
17. 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g) 2C(g);ΔH<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);ΔH<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
缩小体积 |
A的转化率 |
|
D |
升高温度 |
混合气体密度 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com