
题目列表(包括答案和解析)
18.(9分)下列框图中的A-J是中学化学中常见的八种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原子组成的一元含氧弱酸分子, A-J可发生如下转化:

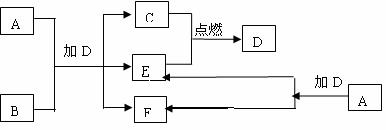
请填写下列空白:
(1)G的名称为 ,F的电子式为 。
(2)15.6gA与D完全反应,转移的电子的物质的量为 。
(3)常温下,A为一种 色的固体,它的一种重要用途是
。
(4)写出D、G反应转化为I和J的离子方程式 。
17.(12分)含氮废水进入水体而对环境造成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原为N2,从而消除污染。
(1)配平以下有关的离子反应方程式:
NO3- + Al+ H2O ―― N2↑ + Al(OH)3 + OH-
(2)以上反应中,失电子的物质是_____________,氧化剂的还原产物是 ,
每生成1 mol这种还原产物,将有_____________摩尔电子发生转移。
(3)现需除去1 m3含氮0.3 mol的废水中的NO3- (设氮元素都以NO3-的形式存在),则至少需要消耗金属铝_____________克。
(4)你对以上治理污染的方案有何评价?
。
16.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)
( )
A.7∶1 B.7∶2 C.7∶3 D.7∶4
|
15.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为
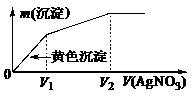
A.(V2-V1)/V1 B.V1/V2 C.V1/(V2-V1) D.V2/V1
14.质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,
若质量分数变为2a%,则物质的量浓度变为 ( )
A.大于2c mol/L B.等于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
13.将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量n的取值范围是 ( )
A.n=l B.l<n<2 C.2≤n<4 D.n≥4
12.下列热化学方程式中的ΔH能表示物质燃烧热的是 ( )
A.2 CO(g) + O2(g) = 2 CO2(g);ΔH = - 566 KJ·mol-1
B.CH4(g) + 2 O2(g) =CO2(g) + 2 H2O(l);ΔH = -890 KJ·mol-1
C.2 H2(g) + O2(g) = 2 H2O(l);ΔH = -571.6 KJ·mol-1
D.H2(g) + Cl2(g) = 2 HCl(g) ;ΔH = -184.6 KJ·mol-1
11.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
9.在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、CO32-、OH-等6种离子。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是 ( )
A.Cu2+、H+、SO42- B.Na+、OH-、CO32-
C.CO32-、OH-、SO42- D.Na+、H+、SO42-
|
A.100mL 1.0mol/L的碳酸钠溶液中,CO32-数目为0.1×6.02×1023
B.常温常压下,2.24L氯气中所含分子数为0.1×6.02×1023
C.78g Na2O2所含过氧离子数为6.02×1023
D.1 mol P在一定量Cl2中燃烧时,转移的电子数为3×6.02×1023
8.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式( )
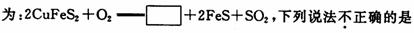
A.方框中的物质应为 Cu2S
B.O2只作氧化剂
C.SO2 既是氧化产物又是还原产物
D.若有 1 molSO2 生成,则反应中有 4 mol 电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com