
题目列表(包括答案和解析)
19.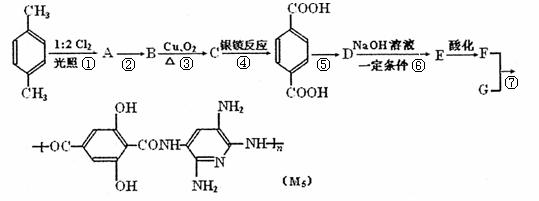 (8分) M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命。下面是M5纤维的合成路线(部分反应未注明条件):4.32
(8分) M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命。下面是M5纤维的合成路线(部分反应未注明条件):4.32
根据上述合成M5纤维的过程,回答下列问题:
(1) 合成M5的单体F的结构简式为_____________。
(2) 在①-⑦的反应中,属于取代反应的是_____________。
(3)写出反应④的化学反应方程式________________。
(4)由四种元素组成的D有多种同分异构体,与D含有相同官能团,且核磁共振氢谱有两个吸收峰的同分异构体共有______________种。
18.(10分)
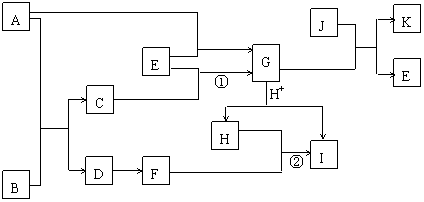 下图中各物质均为中学化学中常见物质,其中A、E、J三种物质为单质;A、B、D、F常温下为气体,D的摩尔质量比F小16,F为一种大气污染物;K是一种比较好的耐火材料,难溶于水,能溶于酸或强碱溶液。它们的相互转化关系如下图所示(图中部分反应物、产物及反应条件未列出)。4.05
下图中各物质均为中学化学中常见物质,其中A、E、J三种物质为单质;A、B、D、F常温下为气体,D的摩尔质量比F小16,F为一种大气污染物;K是一种比较好的耐火材料,难溶于水,能溶于酸或强碱溶液。它们的相互转化关系如下图所示(图中部分反应物、产物及反应条件未列出)。4.05
请回答下列问题:
⑴K的化学式为___________;B的电子式为____________。
⑵反应①的化学方程式为___________________。
⑶反应②的离子方程式为___________________。
17.(10分) 现有部分短周期元素的性质与原子(或分子)结构如下表:7.83
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2) 元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低
b. Y的化合价比Z低
c. Y单质与水反应比Z单质剧烈
d. Y最高价氧化物的水化物的碱性比Z强
(3) T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式__________。
(4)元素T和与氢元素以原子个数1:1化合形成化合物Q,元素X与氢元素以原子个数1:2化合形成常用于火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式_________________。
16.(12分) 某课外活动小组同学,在老师指导下,进行乙醇催化氧化制取乙醛,并探究乙醛发生银镜反应的最佳实验条件。7.00
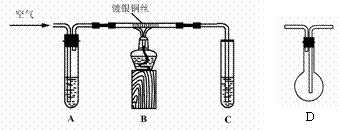 Ⅰ.制取乙醛。拟用右下图(图中铁架台等装置已略去)装置制取乙醛。
Ⅰ.制取乙醛。拟用右下图(图中铁架台等装置已略去)装置制取乙醛。
(1)实验前,首先检查装置的气密性,其操作是___________。
(2)分别向试管A中加入乙醇(乙醇沸点为78.50C),C中加入水。实验时,先加热B装置中的玻璃管,约1 min后鼓入空气,此时铜丝即呈红热状态。该反应的化学方程式为_________________________。
(3)撤走酒精灯,若反应物的流量控制适当,铜丝能长时间保持红热直到实验结束;若反应物量不足,铜丝红热现象就消失。如果需要提高产生乙醇蒸气的速率,可采用的方法是_____________。
(4)认真研究该实验方案后,某同学认为装置中存在不安全之处,建议装置B、C之间接上D装置,你认为这一改进是否合理_______(填“合理”或“不合理”),其理由是___________________________________________________________________。
Ⅱ.探究银镜反应的最佳实验条件。制得的乙醛是一种常用的有机试剂,在碱性和加热条件下,能与银氨溶液发生银镜反应。银镜的光亮程度与反应条件有关。
(5)在一定条件下进行分组实验,部分实验数据录入下表:
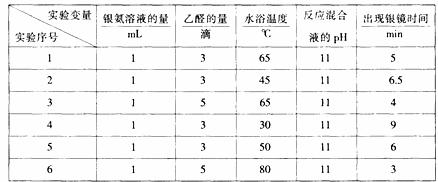
若只进行实验1和实验3,其探究的目的是 。
(6)若还要探究银氨溶液的用量对出现银镜快慢的影响,需要控制的实验条件是 。
15.(8分)工业上从海洋中制溴,先把盐卤(海水中氯化钠被分离后剩下的母液)加热到363K后控制pH为3.5,通入氯气把溴置换出来,再用一种气体X把溴吹出以碳酸钠吸收,这时溴就歧化生成溴离子和溴酸根离子,最后用硫酸酸化,单质溴就从溶液中析出,用此办法从1 t海水中可制得约0.14kg溴。4.41
根据上述信息研究下列问题:
(1)把溴吹出的气体X,工业上最适宜选用( )
A.C2H4 B.空气 C.氩气 D.CO2
(2)用气体X把溴吹出,而不直接利用有机溶剂把溴萃取出来,你认为其中的理由是 _________________ 。
(3)用硫酸酸化,单质溴从溶液中析出后,若实验室进行提取溴的操作,需要用到的玻璃仪器和化学试剂分别是_______________。
(4)提取溴的工厂往往会因为溴的挥发而造成周围空气污染。请你设计一种检验这种被污染的空气中是否还含有单质溴的简单实验方法: 。
14.可用右侧示意图象表示的是2.25
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与水反应 |
H2质量 |
钠 |
 钾 钾 |
|
B |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
400℃ |
500℃ |
|
C |
体积比1:3的N2、H2,在体积可变的恒压容器中,2NH3 N2+3H2 N2+3H2 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2mo1SO2与lmo1O2,在相同温度下2SO2+O2 2SO3 2SO3 |
SO3的物质的量 |
105Pa |
2×105Pa |
第Ⅱ卷(非选择题 共72分)
13.NA表示阿伏加德罗常数,下列叙述中正确的是2.68
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
12.硒(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复印机的硒鼓等等。工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为H2SeO3,主要反应为:2HCl+H2SeO4 = H2SeO3+H2O+Cl2↑然后向溶液中通入SO2使硒元素还原为单质硒沉淀。据此正确的判断为2.21
A.H2SeO4的氧化性比Cl2弱
B.SeO2的氧化性比SO2强
C.H2SeO4的氧化性比H2SeO3强
D.浓H2SeO4的氧化性比HNO3强
11.一定质量某硝酸钾样品中不含可溶性杂质。在10℃时加蒸馏水使之充分溶解,残留固体的质量为250 g。若该实验在40℃下进行时,残留固体质量为120 g,70℃时为20 g。已知KNO3在不同温度下的溶解度:
|
温度 |
10℃ |
40℃ |
55℃ |
70℃ |
|
溶解度 |
20 g |
65 g |
100 g |
140 g |
下列对该样品的推断正确的是2.20
A.样品为纯净物
B.样品中有不溶于水的杂质
C.70℃时的KNO3溶液为饱和溶液
D.当温度在55℃左右时KNO3完全溶解
10.下列离子方程式正确的是2.20
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
B.向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:
Ca2++HCO3-+OH-===CaCO3↓+ H2O
C.在NaOH溶液中通人少量的SO2气体:
SO2+OH- =HSO3-
D.二氧化硅和氢氧化钠溶液反应:
SiO2+2OH-+H2O ===SiO32- + 2H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com