
题目列表(包括答案和解析)
23.(12分)将97.5g锌投入100mL 18.5mol·L-1浓硫酸中充分反应,锌完全溶解,生成的混合气体中SO2和H2的体积比为1∶4。(已知:Zn+2H2SO4(浓)=ZnSO4+SO2+2H2O)求:
(1)生成的混合气体在标准状况下的体积?
(2)室温下,若将反应后的溶液加水稀释至1L,所得溶液的pH为多少?
高三化学阶段性检测试卷
班级 姓名
22.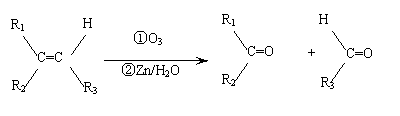 (10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
(10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
已知:
①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
(1)写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中一组):
A ,C ,E 。
(2)写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式 。
21.(14分) 下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明)
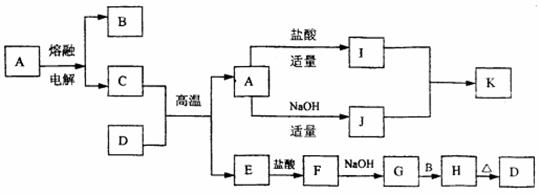
根据图示转化关系填写下列空白:
(1) 写出下列物质的化学式A ,B ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
I+J ® K (离子方程式)。
G+B ® H (化学方程式)。
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
20.(6分) O
‖
抗击“非典”期间,过氧乙酸(CH3C-O-OH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① □MnO4-+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4-+□H2O2+□H+
□Mn2++□O2十□H2O
 ② H2O2+2
② H2O2+2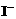 +2H+
I2+2H2O
+2H+
I2+2H2O
O
‖
 ③ CH3C-O-OH+2
③ CH3C-O-OH+2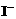 +2H+ CH3COOH+I2+H2O
+2H+ CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
 □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·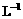 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·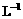 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
19.(8分) 在硝酸生产过程中所排放出来的废气中含有NO和NO2,它们污染环境,现用氨催化还原法将它们转化为无毒气体(填名称) 直接排入空气中。写出有关反应方程式: , 。
假设NO和NO2物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐。写出由烧碱溶液吸收这种混合物的化学方程式: 。
18.(12分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是___________________。
 (2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:____A12Te3+____( )一___A1(OH)3↓+_____H2Te↑
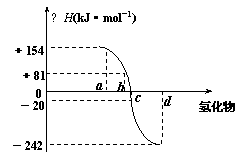
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
①写出氧族元素中含有18e-的两种氢化物的电子式 。
②请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
③写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
17.(10分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),拟用如下实验方案:
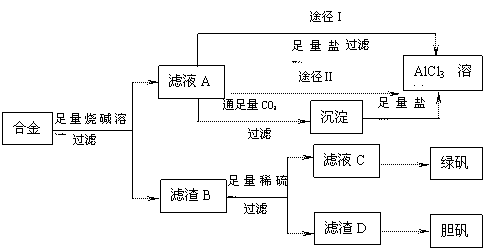

试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 __________________ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
16.相同状况下,在体积相同的三个烧瓶中分别盛NH3、HCl和NO2气体,并分别倒立于水槽,充分溶解后烧瓶内三种溶液物质的量浓度之比为(设烧瓶内液体未扩散到水槽中)
A.1:1:1 B.2:2:3 C.3:3:2 D.2:2:1
第Ⅱ卷 非选择题( 共72分 )
15.向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中
A.溶质为Na2CO3 B.溶质为Na2CO3、NaHCO3
C.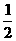 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H +)
14.强热硫酸亚铁固体发生分解反应生成氧化铁、二氧化硫气体、三氧化硫气体,若将产生的气体通入到氯化钡溶液中,则
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com