
题目列表(包括答案和解析)
23、有机粘合剂的粘合过程一般是液态的小分子粘合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α-氰基丙烯酸乙酯(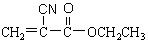 ),请写出“502胶”发生粘合作用的化学方程式:
),请写出“502胶”发生粘合作用的化学方程式:
(2)厌氧胶(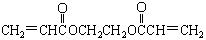 )也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
)也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
(3)白乳胶是常用的粘合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如 。已知含有
。已知含有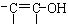 结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;
结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;
( 4)已知醇和醛可以发生反应: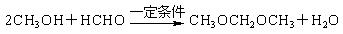 ,聚乙烯醇
,聚乙烯醇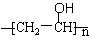 可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
(1) 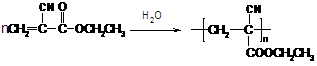 (2分)
(2分)
(2) 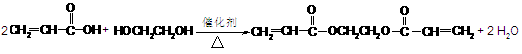 (2分)
(2分)
(3) 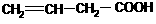 、
、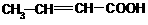 、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)
、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)
(4) 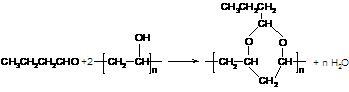 (3分)
(3分)
22、(1)下表列有四种物质的沸点
|
物质 |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
沸点/℃ |
1465 |
1412 |
181(升华) |
57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分) ②SiCl4、AlCl3(2分) ③ ﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③ ﹤(1分)
21、W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。
(1)H、C、O、Na(各1分,共4分)
(2)2和4(1分),σ键,π键
(3)NaHCO3(1分),因为HCO3-中含有O-H键,相互之间可通过O-H┅O氢键缔合(2分)
20、某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42-+3MnO4-+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42-)== ;
FeC2O4 的质量分数为 (精确到0.01%)
(1)重复以上实验1-2次(2分)
(2)用高锰酸钾标准溶液润洗滴定管(2分)
(3)KSCN(1分),溶液中没有出现血红色(1分)
(4)n(Fe2+)==0.001110mol(1分) n(C2O42-)==0.001010mol(1分)
FeC2O4 的质量分数为73.81%(2分)
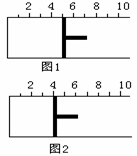
19、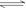 如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平
如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平
衡时,活塞位置如图2所示,则平衡时A的转化率是
A.20% B.40% C.60% D.无法确定
第二卷非选择题(共63分)
18、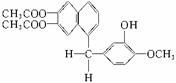 鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
1mol该化合物完全燃烧耗O2的物质的量、与NaOH溶液作
用消耗NaOH的物质的量、其苯环上的一溴代物的种数分别是
A.26 mol、4 mol、7 B.24 mol、4 mol、8
C.26 mol、5 mol、7 D.24 mol、5 mol、8
17、常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(Ac-)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
16、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
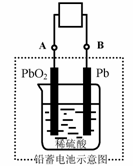 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
15、下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加入过量Ca(OH)2 溶液
2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
14、用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.46g四氧化二氮含有的原子总数为3NA
B.20gD2O中含有D-O键的数目为NA
C.100mL、1mol/L的乙酸溶液中含有H+数为0.1NA
D.2molFeC13制成胶体,所得胶体的胶粒数为2N
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com