
题目列表(包括答案和解析)
25.(13分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有
原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;
D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、
B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)写出C、D两元素形成的原子个数比为1:1的化合物与E、C两元素形成的原子个数比为1:2的化合物反应的化学方程式: 。
(3)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
(4)A与C和E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)B元素的气态氢化物和其一种常见氧化物(双原子分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为 。
(6)在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A44和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
24.(11分)
Ⅰ.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列关于实验的叙述正确的是 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.在两支试管里分别加热NH4Cl和NH4HCO3,现象完全相同
C.在铝热反应的实验中,用滤纸做的漏斗必须干燥
D.用滴有酚酞的水做氨的喷泉实验,只验证了氨的溶解性
E.验证CO2中混有SO2时,可将混合气体通过品红溶液
Ⅱ.实验室可以通过三条途径按不同要求来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热NaNO2(一种致癌物质)与NH4Cl的混合浓溶液制取N2。
如图所示,给出了按上述途径制N2的可供选择的几种实验仪器,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
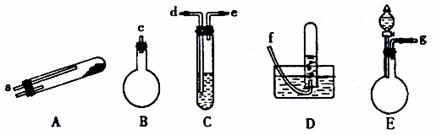
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,最好要用上述仪器中的 (填仪器代码,下同)作为氨气发生装置,该反应的化学方程式为 。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的 (按气流从左到右的顺序列出)。
(2)按途径②制取N2,原料气空气是通过向 (填上述仪器代码)中加入
而送入反应器的。
(3)上述三种制取N2的途径,①和②两条途径常常被协同使用而越来越受到人们的关注,这种方法与途径③相比其优越性在于 。
23.(5分)下列各组物质
① O2和O3 ② H2、D2、T2
③ 12C和14C ④ CH3CH2CH2CH3 和 (CH3)2CHCH3
⑤乙烷和丁烷
⑥ CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5 ⑦
互为同系物的是_______ __, 互为同分异构体的是___ _ __ __,
互为同位素的是____ , 互为同素异形体的是_____ ___,
是同一物质的是________ _。
22.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
|
21.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列正确的是 ( )
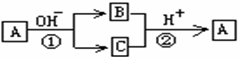 A.X元素可能为铝
A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和② 一定为氧化还原反应
20.由Na2O2、Na2CO3、NaHCO3、Na2O、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出且固体质量增加。下列判断正确的是 ( )
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3、Na2O
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
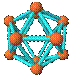
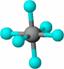
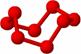
19.观察下列模型并结合有关信息,判断有关说法不正确的是 ( )
|
|
B12结构单元 |
SF6分子 |
S8分子 |
HCN |
|
结构模型示意图 |
 |
 |
 |
 |
|
备注 |
熔点1873K |
/ |
易溶于CS2 |
/ |
A.单质硼属原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H-C≡N
18.一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是 ( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是 ( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
17.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
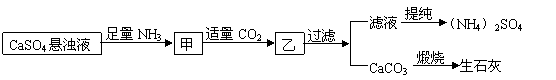
下列推断不合理的是 ( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
16.以下离子方程式书写正确的是 ( )
A.Cl2溶于水:Cl2+H2O == 2H++Cl-+ClO-
B.氨气通入醋酸溶液中:CH3COOH+NH3=CH3COO-+NH4+
C.向Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
D.Al片投入稀硝酸中:2Al+6H+=Al3++3H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com