
题目列表(包括答案和解析)
1、下列物质中,属于含有极性键的离子晶体的是( )
A、CH3COOH B、Na2O2 C、NaOH D、MgCl2
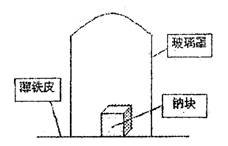
22.(8分)据材料称:钠可在氮气中燃烧生成氮
化钠,氮化钠与水反应的化学方程式是:
Na3N+4H2O=3NaOH+NH3·H2O。某学校化
学研究学习小组,为了研究钠在空气中燃烧
产物的成分,做了发以下实验:
取11.5g钠单质放在一块薄铁皮上,上扣
一玻璃罩(玻璃罩内为干燥且无酸性气体的空
气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧
产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol·L-1HC1溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
21.(8分)已知:①A、B、C为常见的单质,且单质B、C的元素同一主族,单质B、C的相对分子质量相等;
②F为正盐,B和I为气体且B无气味;
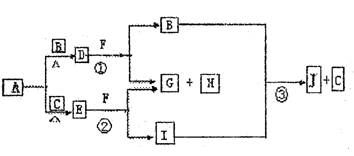 ③沉淀H既可溶于盐酸又可溶于NaOH溶液,D、E的相对分子质量与H相同,向一定量的F溶液中逐渐加入固体粉末D或E,当D或E与F以物质的量之比3:1反应时,生成的沉淀H的量最多。其物质间的转化关系如下:
③沉淀H既可溶于盐酸又可溶于NaOH溶液,D、E的相对分子质量与H相同,向一定量的F溶液中逐渐加入固体粉末D或E,当D或E与F以物质的量之比3:1反应时,生成的沉淀H的量最多。其物质间的转化关系如下:
(1)写出D的电子式 ,E的化学式 。
(2)写出反应①的离子反应方程式 。
写出反应②的离子反应方程式 。
 四、(本题包括1小题,共8分)
四、(本题包括1小题,共8分)
19.(8分)A、B、C、D是四种可溶于水的物质,它们分别由下列阴离子与阳离子两两组合而成,每种离子只能使用一次。
|
阳离子 |
Na+ |
NH4+ |
A13+ |
Ba2+ |
|
阴离子 |
SO42- |
OH- |
CO32- |
NO3- |
将A、B、C、D四种物质溶液两两混合(必要时,有的实验进行加热)其实验现象如下:
①将B溶液和C溶液混合产生白色沉淀,白色沉淀不溶于酸。
②将A溶液和D溶液混合产生白色沉淀,同时有气体生成。
③将A溶液和B溶液混合产生白色沉淀,同时有气体生成。
那么A、B、C、D分别为 、 、 、
。
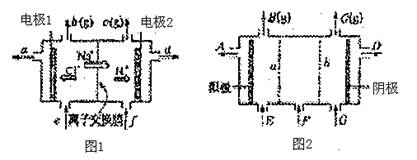 20.(10分)图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性质--只允许阳离子通过,而阻止阴离子和气体通过。
20.(10分)图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性质--只允许阳离子通过,而阻止阴离子和气体通过。
(1)电解后得到的氢氧化钠溶液从 口流出(填字母代号),b口排出的是 气体,电极1应连接电源的 极(填“正”或“负”);理论上讲,从f口加入纯水即可,但实际生产中,纯水要加入一定量的NaOH溶液,其原因是
和
。
(2)图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:a为 (填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)
。
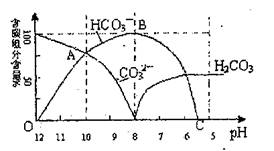 17.(8分)常温下在20mL
0.1mol/L Na2CO3溶液中逐滴加入0.1mol/ L HC1溶液40mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
17.(8分)常温下在20mL
0.1mol/L Na2CO3溶液中逐滴加入0.1mol/ L HC1溶液40mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
回答下列问题:
(1)在0.1mol/L Na2CO3溶液所有
阳离子和阴离子的浓度有何关
系?(用等式表示)
。
(2)当加入盐酸使溶液PH值为10
时,混合液中含碳元素的离子
物质的量之比为 。
(3)随着盐酸的加入,请写出BC段的离子方程式 。
(4)当混合液的PH= 时,开始放出CO2气体。
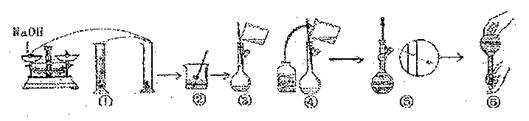 18.(10分)实验室需用480mL 1.0mol/L的NaOH溶液。下图是该学生在实验室配制该NaOh溶液的过程示意图,请据此回答有关问题。
18.(10分)实验室需用480mL 1.0mol/L的NaOH溶液。下图是该学生在实验室配制该NaOh溶液的过程示意图,请据此回答有关问题。
(1)在上述实验过程中,用到的容量的规格是 。
(2)用已知质量为yg的表面皿,准确称取 g NaOH固体。
(3)观察配制NaOH溶液的过程示意图,指出其中有错误的是(填操作序号)。在①-⑥中,没有体现出来的一个重要步骤是:
。
16.已知有机物A中含碳、氧、氮元素,且A分子为中氮原子最少,且A的相对分子质量为128,则A中氢原子数最多为 ( )
A.16 B.14 C.18 D.无法确定
|
14.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向CuSO4溶液中加入一小块金属钠
B.等物质的量浓度、等体积的(NH4)2SO4与BaC12溶液
C.等物质的量NaHCO3与Na2O2固体
D.在NaBr溶液中通入少量氯气
 15.有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱长。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是 ( )
15.有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱长。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是 ( )
A.该晶体属于离子晶体,M呈+2价
B.该晶体属于离子晶体,M呈+1价
C.该晶体的化学式为MFe2(CN)6
D.晶体中与每个Fe3+距离最近且等距离的
CN-为3个
13.为了区别五瓶无色溶液:HC1、A1C13、Ba(NO3)2、NaC1、Na2CO3,四位学生都没有用酒精灯,三位学生另用了试剂(甲另用了酚酞试剂 乙另用了NaOH溶液 丙另用了紫色石蕊试液),丁没有另用任何试剂,其中操作步骤一定最少的是 ( )
A.甲和丙 B.乙 C.乙和丙 D.丁
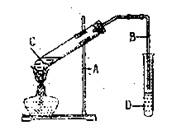
12.右图是实验室制取乙酸乙酯的装置。则下列说法正确的是 ( )
A.右边导管插入饱和碳酸钠溶液
B.反应结束后度管C液体可能会变黑色
C.试管C中加入试剂的顺序是:2mL
浓硫酸→3ml乙醇→2mL乙酸
D.试管D中油状物在下层,饱和碳酸
钠溶液主要为了中和挥发出的乙酸
9.在做中和热的测定实验中,使用下列物品不是为了减少实验误差的是 ( )
A.碎泡沫塑料 B.环形玻璃搅拌棒
C.底部垫纸条 D.两个量筒
|
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的
A1C13
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的
两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
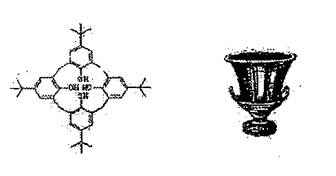 11.对叔丁基苯酚与甲醛缩合形成环状,造成杯状构造,因其分子形状与希腊圣杯(callix crater)相似,且是由多个苯环构成的芳香族分子(arene),由此得名为杯芳(calizarene),也称之为化学家的圣杯,有关杯芳的理解肯定不正确的是 ( )
11.对叔丁基苯酚与甲醛缩合形成环状,造成杯状构造,因其分子形状与希腊圣杯(callix crater)相似,且是由多个苯环构成的芳香族分子(arene),由此得名为杯芳(calizarene),也称之为化学家的圣杯,有关杯芳的理解肯定不正确的是 ( )
A.杯芳不属于烃而属于酚
B.杯底四个酚羟基相互作用,羟基间的作用力属于共价键
C.杯芳能与氢氧化钠溶液、浓溴水及酸性高锰酸钾溶液反应
 D.杯芳的分子式为:C44H56O4
D.杯芳的分子式为:C44H56O4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com