
题目列表(包括答案和解析)
 26.(9分)取标准状况下CH4和过量O2的混合气体840mL点燃,将点燃后的气体用过量碱石灰吸收,碱石灰增重0.600g。
26.(9分)取标准状况下CH4和过量O2的混合气体840mL点燃,将点燃后的气体用过量碱石灰吸收,碱石灰增重0.600g。
(1)碱石灰吸收后所剩气体的体积是多少?(标准状况)
(2)原混合气体中CH4和O2的体积比是多少?
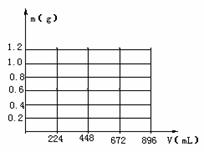
27.将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL。
①在图示坐标系中,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系图象。
②图示坐标系中,生成沉淀的最大质量是 ,沉淀恰好全部溶解时消耗CO2体积为 mL。
③原混合物中KOH的质量为 g。
(2)若KOH和Ca(OH)2以任意比例混合,总质量仍然保持1.3g不变,则消耗CO2总体
积V的取值范围为(取整数) 。
化学试卷评分标准以及说明
24.在某些酶的催化下,人体内葡萄糖的代谢过程如下:

(1)过程①、②、③的反应类型分别是① ② ③
(2)根据质量守恒定律推测,过程④的另一种生成物是 (填化学式)
(3)上述五种物质中, 和 互为同分异构体(填A-E的序号)。
(4)葡萄糖是多羟基的醛,写出它与新制的氢氧化铜发生反应的化学方程式:
(5)在有机物分子中,若一个碳原子与四不同的原子或者原子团相结合,该有机物就有“对映分异构体”,以上A-E的物质中有对映分异构体的是 (填A-E的序号)。
25(13分)据报道,目前我国结核病的发病率有抬头的趋势。拟制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中的一种。它与雷米封可同时服,可以产生协同作用。已知:
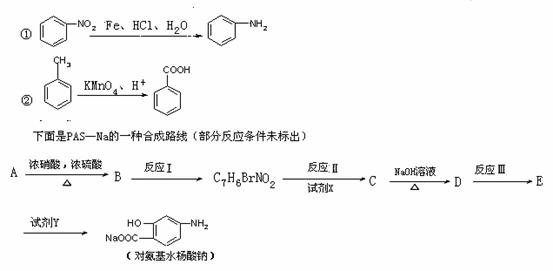
按照要求回答下列问题:
(1)写出下列反应的化学反应方程式并配平
A→B: ;
B→C7H6BrNO2: ;
(2)写出下列物质的结构简式:C: D: ;
(3)指出反应类型:Ⅰ ,Ⅱ ;
(4)指出所加的试剂名称: X Y ;
(5)1mol对氨基水杨酸钠最多能与 molHCl反应。
23.(10分)科学家从化肥厂生产的(NH4)2SO4中检验出组成为N2H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H4+两种形式存在,植物的根系极易吸收N4H4+
,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)与草木灰混合使用。
(3)已知白磷、NH4+、N4H4+的空间构形均为四面体,NH4+的结构为:

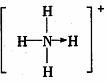
(→表示共用电子对有N原子单方面提供),白磷(P4)的结构为
请画出N4H4+的结构式:
(4)已知液氨中存在着平衡:2NH3≒NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)
和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”在此溶液中加入少
量的强酸或者强碱时,溶液的 pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O+H+=NH4++H2O
加碱时:NH4++OH-= NH3·H2O
由于NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c(H+)与
c(OH-)基本保持不变;
含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
22.(9分)甲、乙、丙为中学常见的单质, A、B、C为中学常见的化合物。可供给参考的信息有:
①A和B都极易溶于水,用两个玻璃棒分别蘸有A和B浓溶液后相互靠近时,会看到白烟。
②甲和乙在一定条件下反应的有关数据见下表
|
项目 |
甲 |
乙 |
A |
|
起始 |
3mol/L |
3mol/L |
0 |
|
2末 |
1.8mol/L |
2.6mol/L |
0.8mol/L |
③它们之间存在如下图所示的转化关系。
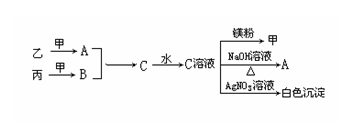
分析上述信息回答下列问题:
(1)实验室制取丙反应的化学方程式为 ,怎样才能得到干燥纯净的丙气体?
(2)用A、B、C的化学式填空:
①水溶液呈现酸性的是 ;②固态属于离子晶体的是
(3)在0~2s内,甲与乙反应生成A的速率v(甲):
(4)写出C与NaOH溶液反应生成A的离子反应方程式:
(5)用离子反应方程式简要表示镁粉与C溶液反应得到甲的过程
,
21.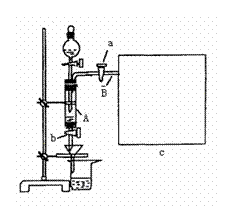 (12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(1)如何检查装置的气密性:
。
(2)滴加盐酸时发现反应速率较之同浓度盐酸与铁反应要快原因是
(3)将烧杯内的溶液用蒸发、浓缩、再降温结晶法得到FeCl3·6H2O晶体,不采用直接蒸发结晶的方法制得晶体的理由是
。
(4)有该法制得的晶体中往往混有Fe(NO3)3,为了制得纯净的FeCl3•6H2O晶体,可将烧杯内的稀硝酸换成
。
(5)若测定废铁屑的纯度,可测出从B中放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 (用含m、V的代数式表示)。请在框图c中画出必要的装置。
20.(9分)某工厂从乙醇、乙酸、乙酸乙酯的混合物中分离出三种物质,回收上述三种物质设计了以下方案:
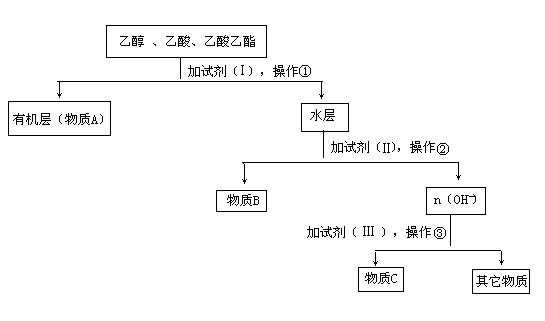
(1)A、B、C是被回收的物质,A、C分别是(写名称)
A C
(2)所用的试剂分别是(写名称)
Ⅰ ,Ⅱ ,Ⅲ 。
(3)三步操作分别是
① ② ③
(4)在实验室中操作①应该在 (填仪器名称)中进行。
19.经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B. 若溶液离子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定是NH4Cl和NH3·H2O
C. 若溶液离子间满足:c(Cl-)>c(NH4+)>c(OH-)>c(H+),则溶液中溶质只有NH4Cl
D.若溶液离子间满足:c(NH4+)=c(Cl-)则溶液中一定呈中性
18.一种新型的净水剂PAFC(聚合氯化铁[AlFe(OH)nCl6-n]m,n<5,m<10),广泛用于生活用水的净化和工业用水的净化,有关PAFC的有关说法正确的是
A.PAFC用于净化饮用水时,比相同量的氯化铝和氯化铁使水的pH改变更大
B. PAFC中铁呈+2价
C. PAFC可以看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中能稳定存在
17.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.钢铁腐蚀时可能发生的反应(正极):2H2O+O2-4e-=4OH-
B.1L、0.5mol/L稀硫酸与1L、1mol/LNaOH溶液反应放出57.3kJ的热
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+H2O(l);△H=-114.6kJ/mol
C.碳酸氢铵溶液与足量的烧碱溶液反应:NH4++OH-=NH3·H2O
D.碳酸氢钠溶液与足量澄清石灰水反应:HCO3-+Ca2++2OH-=CaCO3↓+H2O
16.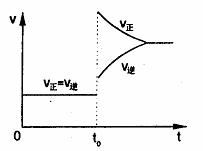 往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g)≒2HI(g);△H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g)≒2HI(g);△H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
A.容器内气体颜色变浅,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2的转化率增大,HI平衡浓度变小]
D.改变条件前后,速率图象如右图
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com