
题目列表(包括答案和解析)
8.下列有关反应热的说法中正确的是
A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ·mol-1,所以,1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
7.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的。不能违背客观实际。下列各说法中,正确的是
A.HCl的水溶液呈强酸性,HF的水溶液也呈强酸性
B.CH4是正四面体结构,SiH4也是正四面体结构
C.Cl2与Fe反应生成FeCl3 ,S与Fe反应生成Fe2S3
D.CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2
6.下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.① B.①② C.①②⑤ D.②④⑤
5.下列反应离子方程式正确的是
A.溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br- + 2Cl2= Fe3+ + Br2 + 4Cl-
B.氯气通入冷的氢氧化钠溶液中: 2Cl2 + 2OH- = 3Cl- + ClO-+ H2O
C.向澄清石灰水中加入少量小苏打溶液:Ca2+ + OH-+ HCO3- =CaCO3↓+ H2O
D.氨水中通入过量二氧化硫: 2NH3·H2O + SO2 = 2NH4+ + SO32-+ 2H2O
4. 阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.0.1L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5gSiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
2.下列比较正确的是
A.熔沸点高低:CH4 < SiH4 < GeH4< SnH4
B.离子半径大小:Cl-< Mg2+< O2-< F-
C.分散质微粒直径大小:Fe(OH)3胶体> CaCO3悬浊液> NaCl溶液
D.酸性强弱:H2SO4 < H3PO4 < H2SiO3
|
式为:2KNO3+S+3C K2S+N2↑+3CO2↑,下列有关叙述中正确的是
A.在黑火药爆炸的反应中,硝酸钾为氧化剂,硫磺和木炭为还原剂
B.在黑火药爆炸的反应中,当有1molKNO3反应时,转移电子的总物质的量为5mol
C.三种反应物可以形成三种不同类型的晶体,三种生成物可以形成两种不同类型的晶体
D.在K2S晶体中,K+与S2-电子层结构相同,但K+半径大于S2-半径
1.2008年将在我国北京举行夏季奥运会,这次奥运会提出要突出“绿色奥运、科技奥运、人文奥运”的理念,其中绿色奥运是指
A.运动员的食品全部是未加任何添加剂的食品
B.所有奥运用品全部是天然绿色植物
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.把环境保护作为奥运设施规划和建设的首要条件
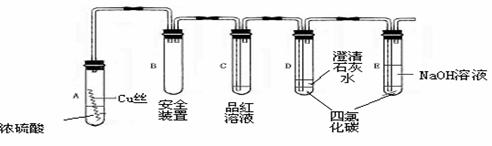
29.某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固 定仪器和酒精灯均未画出)实验选用细铜丝.98.3% H2SO4.品红溶液.澄清石灰 水.CCl4.NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在 液面上方。
 以下是该学习小组部分交流记录及后续探究实验的记录
以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
⑴A试管上方的长导管的作用是_______;D.E两支试管中CCl4的作用是_____________。
⑵加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_____ ________。
⑶对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:_____________。设计实验验证你的猜想____________。
⑷根据上述研究,你认为液面下方铜丝表面的黑色物质成分是__________。(写化学式)
28.X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。请填空:
⑴Y、Z和W三种元素是否位于同一周期(填“是”或“否”): _____________,理由 是__________________________________________________;
⑵Y是_____________,Z是_____________,W是_____________;
⑶X、Y、Z和W可组成一化合物,其原子个数之比为8︰2︰4︰1。写出该化合物的名 称及化学式是____________________。
27.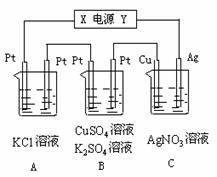 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:
(1)电源电极X名称为_____________。
(2) PH变化:(填增大或减小或不变) A_____________B_____________C_____________。
(3) 通电5min时,B中共收集224mL气体(标准
状况),溶液体积为200mL(设电解前后溶液体积无
变化),则通电前硫酸铜溶液的物质的量浓度为
_____________。
(4) 若A中KCl溶液的体积也是200mL,电解后
溶液中的OH‑的物质的量浓度为_____________。
(设电解前后溶液体积无变化)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com