
题目列表(包括答案和解析)
25.(16分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、B、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子灵敏之和与D的最外层电子数相等。
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为 ,
若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为 ,外电路中通过的物质的量为
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为
24.(14分)某研究性学习小组对铝热反应实验展开研究。某高中化学教材中对“铝热反应”
的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的溶点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答 (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
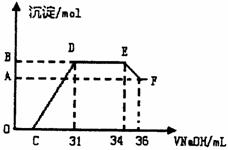 Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上这的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试回答下列问题:
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上这的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生
反应的离子方程式为 。
(2)在DE段,沉淀的物质的最没有变化,
则此阶段发生反应的离子方程式为
上述现象说明溶液中的离子结合OH-
的能力最强的是 最弱的是
(填离子符号)
(3)B与A的差值为 mol。
23.(4分)下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用氨水清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.在250ml烧杯中加入216mL水和24g NaOH固体,配制质量分数为10%NaOH溶液
F.发生急性硫化氢中毒,应迅速将患者转移到空气新鲜的地方,对患者实行人工呼吸,并迅速送医院救治。
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
H.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
I.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
21. 在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是 ( )
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是 ( )
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
A.在上述条件下反应生成1mol SO3固体放热Q/2kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
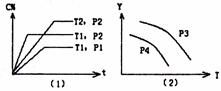
 22.在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g);△H<0,符合下图所示图象(1)的关系。由此推断对图象(2)的正确说法是 ( )
22.在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g);△H<0,符合下图所示图象(1)的关系。由此推断对图象(2)的正确说法是 ( )
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的百分含量
C.P3>P4,Y轴表示混合气体密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
|
20.氢化铵(NH4H)与氯化铵的结构相似,又如NH4H与水反应有氢气生成,下列叙述正确的是 ( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体投入少量水中,有两种气体生成
19.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是 ( )
A.溶液中水电离出的c(H+)=10-10mol·L-1
B.溶液中c(H+)+c(A-)=0.1mol·L-1
C.与0.05mol·L-1 NaOH溶液等体积混合所得溶液中离子浓度大小关系为:
c(A-)> c(Na+)> c(OH-)> c(H+)
D.原溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
18.下列是除去括号内杂质的有关操作,其中正确的是 ( )
A.分离苯和己烷:蒸馏
B.NO(NO2)--通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶
D.乙醇(乙酸)--加足量NaOH溶液,蒸馏
16.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子。电池工作时,甲醇被氧化为二氧化碳和水,氧气的电极上的反应是:O2+4H++4e- 2H2O。下列叙述中,不正确的是 ( )
A.电池的总反应是:2CH3OH+3O2 2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e- CO2↑+6H+
C.负极的反应为;O2+4H++4e- 2H2O
D.电池工作时,H+由正极移向负极
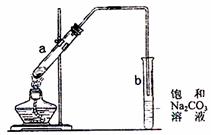 17.右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
17.右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
A.向a试管中先加入浓硫酸,然后边摇动
试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面
的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将
乙酸乙酯蒸出,使平衡向生成乙酸乙酯
的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
15.向含Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有明显变化的是 ( )
A.Fe2+ B.NH4+ C.Fe3+ D.Mg2+
14.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com