
题目列表(包括答案和解析)
3.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
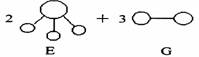
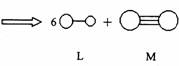
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
2.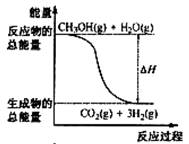 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
1.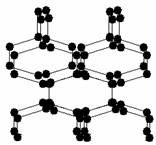 2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如右图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如右图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是
A、按键型分类,该晶体中含有非极性共价键
B、含N5+离子的化合物中既有离子键又有共价键
C、高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D、这种固体的可能潜在应用是烈性炸药或高能材料
26.(6分)
(1)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O试写出电解质溶液若为盐酸时的正极反应式:__________________________________________。
(2)已知4g甲烷气体充分燃烧生成CO 2(气体)和H2O(液)时,放出Q kJ的热量。写出甲烷燃烧热的热化学方程式:_____________________________________________。
(3)已知下列热化学方程式:
①.Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -Q1kJ/mol
②.3Fe2O3(s) + CO(g) = 2Fe3O4 (s) + CO2(g) △H= -Q2kJ/mol
③. Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H= -Q3kJ/mol
利用盖斯定律计算:FeO(s) + CO (g)= Fe(s) + CO2(g) 的焓变△H=______________。
25.(16分)某化学小组的同学进行研究性学习时,决定自己动手探究NO2能否支持燃烧的问题。
(1)甲组同学设计的方案是:向烧瓶中加入适量的浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的木条伸入烧瓶中,发现木条火焰熄灭。
①.写出浓硝酸受热分解的化学方程式:__________________________________。
②.根据甲组同学设计的方案,能不能得出NO2不支持燃烧的结论?___________(填能或不能)。推断的理由是:____________________________________________
___________________________________________________________________。
③.当烧瓶中充满红棕色气体时,将带火星的木条伸入烧瓶中,木条复燃了。有同学得出NO2能支持木条燃烧的结论。你认为这一结论是否正确?_____________(填正确或不正确)。理由是:________________________________________________
___________________________________________________________________。
(2)乙组同学通过查资料得知,某些不活泼金属的硝酸盐受热时也能产生NO2气体。
例如:2Cu(NO3) 2 2CuO +4NO 2↑+O 2↑,2AgNO3
2CuO +4NO 2↑+O 2↑,2AgNO3 2Ag +2NO
2↑+O 2↑。他们根据此原理设计如图甲所示的实验装置(加热、夹持
2Ag +2NO
2↑+O 2↑。他们根据此原理设计如图甲所示的实验装置(加热、夹持
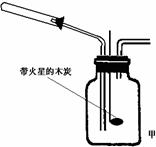 仪器未画出),并分别用硝酸铜和硝酸银进行实验,实
仪器未画出),并分别用硝酸铜和硝酸银进行实验,实
验中发现当红棕色气体进入集气瓶后,带火星的木炭
均能复燃,乙同学由此得出NO2支持燃烧的结论。
①.乙组同学使用该装置进行实验时,从环保的角度考
虑。应采取的措施是:____________________________。
②.指导老师认为乙组同学进行的两个实验中,有一个实验
所得结论是不可靠的。你认为不可靠的实验选用的反应物是:
____________,该实验所得结论不可靠的原因是:
________________________________________________________________。
24.(14分)根据下列题目要求,回答下列问题:
(1)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。事实上,硫酸的第一步电
离是完全的:H2SO4= H++
HSO4-,第二步电离并不完全:HSO4-  H++
SO42- 。
H++
SO42- 。
①.则Na2SO4溶液呈__________(填弱酸性、中性或弱碱性),其理由是(用离子方程式表示)______________________________________________。
②.写出硫酸与氯化钡溶液反应的离子方程式:______________________________。
(2)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是:_____________________________________________;
在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是:___________________________________________________________。
(3)把氯化亚铁水溶液中的Fe2+氧化为Fe3+,而不引进金属阳离子或其它原溶液中不含有的阴离子,所用的两种方法的离子方程式分别为:
①.______________________________________________________;
②.______________________________________________________。
23.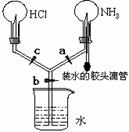 (4分)如图所示的装置,实验前a、b、c活塞均关闭。
(4分)如图所示的装置,实验前a、b、c活塞均关闭。
(1)要在该装置中产生喷烟现象,
其操作方法是:
。
(2)若要在该装置中产生双喷泉现象,其操作方法是:
。
22.(6分)根据题目要求回答下列问题:
(1)化学实验时,下列处理方法不正确的是__ ______ _(少选得一半的分,错选不得分)
A.金属钠失火,用泡沫灭火器扑灭
B.用瓷坩埚熔融氢氧化钠或碳酸钠固体
C.用滴有酚酞的水做喷泉实验,只验证了氨气的溶解性
D.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼
E.温度计的水银球破裂后,掉在地上的水银应用洒硫粉的方法除去
F.实验桌上的酒精灯失火后,立即用湿抹布盖灭
G.配制FeCl2溶液先将FeCl2溶解在盐酸中,再加入蒸馏水稀释,最后加少量铁粉
(2)就教材中氢氧化铁胶体的制备实验中应该注意的事项,回答:向沸水中滴加饱和氯化铁溶液,稍微加热煮沸,不宜长时间加热。这样操作的原因是:
__________________________________________________________________。
(3)在100ml的混合溶液中硝酸和硫酸的物质的量浓度分别是0.4mol/l和0.1mol/l,向该混合溶液中加入1.92g铜粉,所得溶液中Cu2+的物质的量浓度为:________。
21.(4分)某溶液由Na+、Cu2+、Ba2+ 、Fe3+、 AlO2-、CO32- 、SO42-、Cl-中的若干种离子组成。
取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②向①所得的溶液中加入过量氨水,产生白色沉淀,过滤;
③向②所得的溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④向③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液一定不存在的离子是:_____________________________________;
(2)原溶液一定存在的离子是:______________________________________。
20.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物
 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是 ( )
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.溶液A和溶液B选用稀硝酸
C.若溶液B选用浓硝酸,测得铜的质量分数偏小
D.实验室中方案Ⅱ更便于实施
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com