
题目列表(包括答案和解析)
23.(10分)⑴已知:Fe3O4可改写为FeO· Fe2O3,Pb3O4可改写为2PbO· PbO2。
甲同学在做铁与氯气的反应后,测得生成物的化学式是Fe3Cl8。乙同学在做铁与碘的反应时,测得生成物的化学式是Fe3I8。仿照上述形式,Fe3Cl8可改写为
Fe3I8可改写为 。乙同学在做铁与碘的反应时, 是过量的。⑵ 又已知Fe3O4还可改写成盐的形式:Fe (FeO2)2。请把下列化合物改写成盐的形式:
Pb3O4(铅酸铅) I4O9(碘酸碘)
22.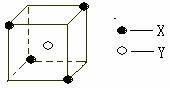 (11分)某离子晶体晶胞结构如图所示:
(11分)某离子晶体晶胞结构如图所示:
X位于立方体的顶点,Y位于立方体的中心。
⑴晶体中每个Y同时吸引着 个X,
每个X同时吸引着 个Y,
该晶体的化学式是 。
⑵晶体中每个X周围与它最接近且距离相等的X共有 个。
⑶该晶体的摩尔质量M g/mol,密度为ρg/cm3,阿伏加德罗常数为NA。晶体中两个距离最近的X之间距离为 cm。
⑷某气态分子也具有上述图形的空间结构,该分子的化学式是 , 图形中∠XYX的度数是 。该分子是以 键结合成的 分子(填“极性”“非极性”)。
21.(11分)A、B、C是三种分别属于不同周期的主族元素,原子半径C>A>B,A的+2价离子具有与氖原子相同的电子层结构,B元素的最高价氧化物对应水化物的酸性在所属周期中最强,C元素的族序数为A、B两元素的族序数之和。
⑴A元素位于周期表中 周期 族。
⑵写出B元素氢化物的电子式 ,该化合物具有易液化的性质,这是因为 。
⑶已知B、C两元素的氢化物相遇会产生大量白烟,写出其生成物的电子式
该化合物的晶体属于 晶体。
⑷写出A、B元素形成的化合物与足量盐酸反应的离子方程式
。
|

① KClO3+ HCl == KCl+ Cl2↑+ H2O
② KClO3+ HCl == KCl+ Cl2↑+ ClO2↑+ H2O
⑵上述反应①中,电子转移的数目x= ;
上述反应②中,还原产物是 。
⑶已知ClO2是黄绿色气体,具有很强的氧化性,常被用作消毒剂。若在相同温度,相同压强下,利用反应①、②分别制得等体积的气体,两者消毒效率之比是 。
20.(9分)在标准状况下,将V LCl2通入体积为100mL,浓度是1mol/L的FeBr2溶液中。(已知氧化性:Br2>Fe3+)
⑴若V<1L,写出反应的离子方程式
。
⑵若V=2.24L,写出反应的离子方程式
。
⑶若反应后溶液中有 的Br-被氧化,V= L。
的Br-被氧化,V= L。
18.300K时,2SO2(g)
+ O2(g) 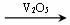 2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
( )
2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
( )
A.Q2< Q1<2Q2 α1<α2 B.Q1=196.6 kJ α1>α2
C.Q2 <98.3 kJ α1=α2 D.Q1>2Q2 α1>α2
第Ⅱ卷(非选择题 共76分)
17.等物质的量的A2、B2
在一定条件下反应:m A2(g)+ n B2(g)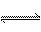 p C(g)达到平衡时,测得C(A2)=0.9mol/L,C(B2)=0.1mol/L,C(C)=0.8mol/L,则C的化学式可能是
( )
p C(g)达到平衡时,测得C(A2)=0.9mol/L,C(B2)=0.1mol/L,C(C)=0.8mol/L,则C的化学式可能是
( )
A.A2B3 B.AB3 C.A2B4 D.A2B5
16.X+ 、Y+ 、Z2-是三种主族元素形成的离子,X+ 与Z2-具有相同的电子层结构,Y和Z处于同一周期。下列说法正确的是 ( )
A.原子序数:X>Y>Z
B.原子半径:Y>Z>X
C.离子半径:Z2->X+>Y+
D.在不同条件下,X、Z两元素可能形成X2Z2和X 2Z两种化合物
15.有A、B、C三种短周期元素,已知A元素原子最外层电子数等于其电子层数,B元素原子最外层电子数是其电子层数的2倍,C元素原子最外层电子数是其电子层数的3倍。这三种元素形成的化合物不可能是 ( )
A.A3BC4 B.A2(BC4)3 C.A2B2C2 D.A2BC4
14.NaH是一种离子化合物,能与水反应生成氢气,也能与乙醇、液氨等反应生成氢气。
下列关于NaH的叙述正确的是 ( )
A.跟水反应时,水作氧化剂
B.NaH中阴离子半径小于Li+的半径
C.跟液氨反应除生成氢气外,还生成铵盐
D.与乙醇反应产生氢气的速率比与水反应更快
13.已知: 2 H2(g)+O2(g)== 2 H2O(l);△H=-571.6 kJ/mol,
CO(g)+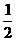 O2(g)== CO2(g);△H=-282.9 kJ/mol
O2(g)== CO2(g);△H=-282.9 kJ/mol
若H2、CO混合气完全燃烧放出113.74 kJ热量,同时生成3.6 g水,则混合气体中H2、CO分子数之比是 ( )
A.2∶1 B.1∶2
C.1∶1 D.2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com