
题目列表(包括答案和解析)
24.已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……,今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=2B2-+2HA C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是 .
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子,最易结合质子(H+)的是 最难结合质子的是 .
(3)下列反应的离子方程式正确的是 .A.H3C+3A-=3HA+C3-阶 B.HB-+A-=HA+B2-
(4)完成下列反应的离子方程式
A.H3C+OH-(过量)= B.HA(过量)+C3-=
23.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
22.(1)有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液 ②20毫升0.50摩/升硫酸水溶液 ③30毫升0.40摩/升HCl溶液 ④40毫升0.30摩/升CH3COOH水溶液 ⑤50毫升0.20摩/升蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________。
(2)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=__________(填数据);②若x+y=13,则a/b=_________(填数据);
③若x+y>14,则a/b=___________(填表达式);
21.现有浓度为0.1
mol·L-1的五种电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,已知:CO2+3H2O+2AlO2- 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是____________________(填编号,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是__________;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是____;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式______________________________________。
20. 以水为溶剂进行中和滴定的原理是:H3O++OH-
以水为溶剂进行中和滴定的原理是:H3O++OH- 2H2O。已知液态SO2和纯水的导电性相近,液态SO2也能发生自电离:2SO2 SO +SO2+;△H>0。下列叙述中错误的是
+SO2+;△H>0。下列叙述中错误的是
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:SO +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
19.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) a+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol·L-1
18.常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
A.pH =12 的Ba(OH)2 B.pH =12的氨水 C.0.005mol/L NaOH D.0.05mol/LBaCl2
17.将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32-) B.能使酸性高锰酸钾溶液褪色
a+)等于c(CO32-)与c(HCO3-)之和 D.c(HCO3-)略小于c(CO32-)
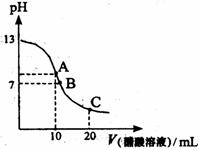
16.25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:
A.在A点:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
B.在A点:c(Na+)+ c(H+)==c(OH-)+c(CH3COO-)
C.在B点:c(CH3COO-)> c(Na+)> c(H+)= c(OH-)
D.在C点:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
15. 已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:
已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com