
题目列表(包括答案和解析)
2、引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有机物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.SO2、NO2或CO2都会导致酸雨的形成
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
1、汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是
A.燃烧含氮化合物燃料引起的 B.燃烧含铅汽油引起的
C.是由于燃烧不充分引起的 D.是在气缸中N2被氧化生成的
29.(16分)A、B、C、D、E均为有机化合物,转化关系如下:
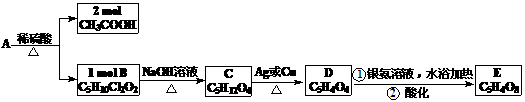
已知:同一个碳原子上不能同时连两个羟基。请回答:
(1)化合物A的分子式__________________
(2)B的结构简式_______________________
(3)写出A→B,C→D的有机反应类型:A→B___________反应 C→D________反应
(4)B不能发生的反应是__________________
①氧化反应 ②取代反应 ③消去反应 ④水解反应 ⑤加聚反应
(5)写出D与足量的银氨溶液在一定条件下反应的方程式
____________________________________________________________ (6)分子式为C5H12O4的四元醇共有_______种。
[亲本的表现型和基因型4分;子代基因型、表现型及比例2分;符号1分(共7分)]
(3)多(1分) 同一(1分) DNA连接酶(1分) 抗虫基因在玉米体内得到表达(1分)
(4)播种上述种子(1分)→ 成熟后取其花粉,离体培养得到四种单倍体幼苗(2分) → 用适宜浓度的秋水仙素处理即得到二倍体植株(1分) → 从中选择出雄株和雌株即可(1分)(共5分)
28.(15分)某校化学课外活动小组利用下图装置制备氯化铝固体,并用该固体配制氯化铝溶液。装置中a为长玻璃导管,b为玻璃活塞。实验中可供选用的试剂有:①二氧化锰固体;②铝粉;③氯化钠固体;④浓硫酸;⑤浓盐酸;⑥蒸馏水;⑦碱石灰。资料表明:氯化铝受热至180℃时即升华,在潮湿的空气中易水解。

回答下列问题:
(1)检查该装置气密性的方法是___________________________________。
(2)A中气体制备的离子方程式是_________________________。如果可供选择的试剂中无浓盐酸,该小组同学用已供试剂也完成了该实验,则A装置中选用的试剂是____(填序号)。
(3)实验中B装置的作用是_________________________________。
(4)D、E间导管短且粗,原因是___________________________。
(5)用实验制得的氯化铝固体配制溶液的方法是_______________________。
(6)请在E后的虚线框中补充完善该装置。该装置中应盛放的试剂是______(从题中可供试剂中选择,填序号)。
27. (14分)下图表示中学部分常见物质间的相互转化关系,每个字母代表一种物质,每个序号代表一个反应。各步反应的反应物、生成物均已标出,但反应条件均已略去。已知A、F是常见金属单质,C、D、G是氯碱工业上电解K的饱和溶液的产物,L、M分别为白色胶状沉淀和红褐色沉淀。
(14分)下图表示中学部分常见物质间的相互转化关系,每个字母代表一种物质,每个序号代表一个反应。各步反应的反应物、生成物均已标出,但反应条件均已略去。已知A、F是常见金属单质,C、D、G是氯碱工业上电解K的饱和溶液的产物,L、M分别为白色胶状沉淀和红褐色沉淀。
回答下列问题: (1)金属A的化学式为_______,反应①的原理可以应用在生产上,称为_________反应; (2)反应①~⑦中属于水解反应的是_________________; (3)工业上电解K的饱和溶液的阳极的电极反应式为___________________________; (4)写出反应③的化学反应方程式,并标明反应条件_______________________________; (5)反应①中,10.8gA的单质与足量B充分反应,可得到F的质量为____________; (6)反应②③互为可逆反应,试用平衡移动原理解释反应②可以在硬质玻璃管中较彻底进行的 原因______________________________________________________________________。
26.(15分)A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期。它们中的两种元素可形成多种原子个数比为1﹕1的化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表:
|
化合物 |
甲 |
乙 |
丙 |
丁 |
|
元素种类 |
A、B |
A、C |
A、D |
C、D |
通常情况下,甲为气体,密度比空气略小;乙为液体;丙和丁为固体且均为离子化合物。请填写下列空白:
(1)D元素的原子结构示意图为 ,乙的电子式为 ,丁中阴离子与阳离子的个数比为 ;
(2)已知在标准状况下,5.6升的甲完全燃烧放出的热量为325 KJ,试写出表示甲的燃烧热的热化学方程式: ;
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式 ;
(4)已知丙的晶体结构与NaCl相似,则该晶体中与D离子距离最近的D离子有 个;有资料显示,丙是一种危险物质,其反应活性很高,在潮湿的空气中能自燃。试解释原因(用化学方程式表示)
13.铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现有2mol/L稀硫酸30mL,往其中加入1.7gNaNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为 A.0.045mol B.0.03mol C.0.0225mol D.0mol
12.如图所示装置中,a、b都是惰性电极,通电一段时间
后,b极附近溶液呈红色,则下列说法正确的是
A.x是正极,y是负极,CuSO4溶液的pH逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
11.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中不正确的是
pC(g)+qD(g);△H<0。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
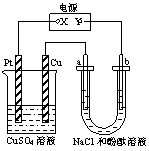 D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
10.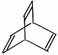 有机物的结构可用“键线式”简化表示。如CH3-CH=CH-CH3可简写为
有机物的结构可用“键线式”简化表示。如CH3-CH=CH-CH3可简写为
 。有机物X的键线式为 下列说法不正确的是
。有机物X的键线式为 下列说法不正确的是
A.X的化学式为C8H8
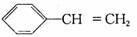 B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式:
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式:
C.X能使酸性的高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com