
题目列表(包括答案和解析)
14.以水为溶剂进行中和滴定的原理是:H3O++OH―= 2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2 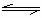 SO
SO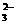 +SO2+;△H>0。下列叙述中,错误的是 ( )
+SO2+;△H>0。下列叙述中,错误的是 ( )
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:
SO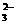 +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO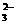 )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
13.某固定体积的密闭容器中充入a molA发生反应: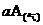
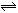
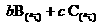 ,在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是( )
,在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是( )
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变小
12.在容积不变的密闭容器中,在一定条件下发生反应:2A B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
11.某黄色溶液中含有下列离子:K+、NH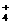 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO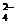 、HCO
、HCO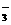 、Cl-、S2-中的两种或多种,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是 ( )
、Cl-、S2-中的两种或多种,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是 ( )
A.溶液中存在Fe3+ B.溶液中可能存在大量Ba2+
C.溶液中不存在大量HCO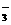 和S2- D.溶液可能呈强碱性
和S2- D.溶液可能呈强碱性
10.在一体积为1L密闭容器中发生如下化学反应:2A(g) 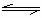 B(g)+C(g)。当物质A的起始浓度为1.0
mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0
mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
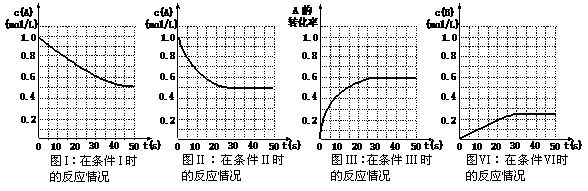

则下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能缩小了容器体积
|
9.在一真空密闭的定容容器中放入N2O4晶体并使之气化,当反应N2O4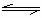 2NO2建立平衡后,再通入一些N2O4气体(温度不变),待反应再次达到新的平衡.则平衡混合气体中
2NO2建立平衡后,再通入一些N2O4气体(温度不变),待反应再次达到新的平衡.则平衡混合气体中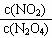 的比值.新平衡与旧平衡相比( )
的比值.新平衡与旧平衡相比( )
A.新平衡时大 B.新平衡时小 C.不变 D.无法确定
8.将一定量的固体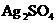 置于容积不变的1L密闭容器中(装有少量催化剂),某温度下发生反应:
置于容积不变的1L密闭容器中(装有少量催化剂),某温度下发生反应: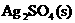

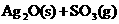 ,
,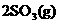

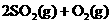 ,反应经过10 min达到平衡,测得c(SO3)=0.4mol•L―1,c(SO2)=0.1mol•L―1,则下列叙述中不正确的是( )
,反应经过10 min达到平衡,测得c(SO3)=0.4mol•L―1,c(SO2)=0.1mol•L―1,则下列叙述中不正确的是( )
A.容器里Ag2O的物质的量为0.5mol
B.SO3的分解率为20%
C.在这10 min内的平均反应速率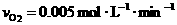
D.缩小容器体积,达到新平衡后c(SO3)大于0.4mol•L―1
7.已知工业上真空炼铷的原理如下: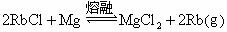 ,对于此反应的进行能给予正确解释的是( )
,对于此反应的进行能给予正确解释的是( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性不如RbCl强
D.铷的游离状较化合态更稳定
6.四个试管中都装有5mL 0.1mol•L―1 Na2S2O3溶液,分别在不同温度下加入0.1mol•L―1硫酸和一定量水,最先出现浑浊的是( )
A.20℃,8 mL硫酸,2 mL水 B.20℃,5 mL硫酸,5 mL水
C.30℃,8 mL硫酸,2 mL水 D.30℃,4 mL硫酸,6 mL水
5.室温下,体积相同pH均为3的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 ( )
A.加水稀释10倍后,两溶液的pH均为4
B.使温度都升高20℃后,两溶液的pH均不变
C.加适量的醋酸钠晶体后,醋酸溶液pH均增大,盐酸pH不变
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com