
题目列表(包括答案和解析)
25.(12分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+
+ HA-,HA- H++A2-
H++A2-
试回答下列问题:
(1)NaHA溶液显 (填“酸性”,“中性”,或“碱性”),溶液中存在的平衡的方程式
。
Na2A溶液显 (填“酸性”,“中性”,或“碱性”),原因: 。
(用离子方程式表示)
(2)V1L pH = 2的NaHA溶液和V2L pH = 2的HCl溶液,分别与pH = 12的NaOH溶液1L恰好反应,则V1 V2(填“>”、“<”、“=”)。
V3L 0.01mol•L―1的NaHA溶液和V4L 0.01mol•L―1的HCl溶液,分别与pH = 12的NaOH溶液1L混合后,溶液呈pH=7,则V3 V4(填“>”、“<”、“=”)。
(3)0.1mol·L-1 Na2A溶液中各种离子浓度由大到小的顺序是 。
24.(7分)在温度为830 K时,1L的恒容容器中存在可逆反应:

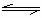
 2
2
若起始浓度c(CO)为2mol•L―1、c(H2O)为3mol•L―1,反应达平衡时, c(H2)=1.2mol•L―1。填写以下空白:
①平衡时,H2的体积分数为φ(H2)=
;H2O的转化率α(H2O)=
。若起始浓度c(CO)为2mol•L―1、c(H2O)为1mol•L―1,重新达平衡时,CO的转化率________, 的转化率________(均填“提高”、“降低”或“不变”)
的转化率________(均填“提高”、“降低”或“不变”)
②该反应的平衡常数K= 。(填写计算结果)
设830 K时,起始浓度c(CO)为 ,c(H2O)为
,c(H2O)为 ,反应达平衡时c(H2)为
,反应达平衡时c(H2)为
③用以表示a、b、c之间关系的代数式为:_________。(2分)
23.(10分)下列反应在210℃时达到平衡:
①PCl5(g)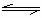 PCl3(g)+Cl2(g);△H1>0 K1=1mol·L-1
PCl3(g)+Cl2(g);△H1>0 K1=1mol·L-1
②CO(g)+Cl2(g)
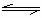 COCl2(g);△H1<0 K2=5×104L·mol-1
COCl2(g);△H1<0 K2=5×104L·mol-1
③COCl2(g)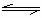 CO(g)+Cl2(g)
CO(g)+Cl2(g)
④2SO2(g)+O2(g)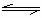 2SO3(g);△H4<0
2SO3(g);△H4<0
(1)反应③的平衡常数K3= 。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号)。
A.降低反应①、②体系中Cl2浓度 B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度 D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入2molSO2和1molO2,乙中加入2molSO3气体,开始时两容器压强相等,最后分别达到平衡。下列有关它们达到平衡状态后的叙述正确的是
(填序号)。
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,容器内气体总物质的量为12mol。现向容器中加主xmolSO2,6.5mol O2,2.0molSO3。①若x=5.5,需要 (填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为 。
21(12分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,称重质量为ag,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)刚刚开始时产生气泡速率慢,其原因是 。反应一段时间后,反应速率明显加快,其原因是 。
(3)写出所形成原电池负极是: 。
(4)欲利用此反应测定合金中铝的含量,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的
形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式: 。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加7 mL C1mol·L-1NaOH之后,
改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如下图
所示。
据此,回答下列问题:

(5)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体
积的两倍,则C1/C2= ;
(6)B点时溶液呈碱性的原因 (用离子离子方程式表示)
22.(10分)(1)实验室配制FeCl2溶液时,需加入少许盐酸和铁粉。
只加盐酸、不加铁粉,溶液在配制过程中会发生什么变化,用离子方程式表示为 ;滴加盐酸的原因 (用离子方程式和简明文字表示)
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
已知不同金属离子在溶液中完全沉淀时,溶液的pH不同。
|
溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
完全生成氢氧化物沉淀时,溶液的pH |
≥3.7 |
6.4≥ |
≥4.4 |

①下列氧化剂中最适合做氧化剂X的是 (填序号)
A.NaClO B.H2O2 C.KMnO4 D.I2
②物质Y的化学式是 ;
③写出难溶物Z在水中的沉淀溶解平衡方程式: 。
20.温度相同、浓度均为0.2 mol/L的 ①(NH4)2SO4、 ②NaNO3、 ③NH4HSO4、 ④NH4NO3、⑤CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
A.③①④②⑤ B.①③⑤④② C.③②①⑤④ D.⑤②④①③
第Ⅱ卷(共80分)
19.下列叙述正确的是 ( )
A.将pH=2 H2SO4与pH=12 NH3·H2O溶液等体积混合后,混和液pH<7
B.将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混和液13<pH<14
C.pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7
D.某温度下水的离子积为1×10-12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比为10:1
18.下列各离子浓度的大小比较,正确的是 ( )
A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,
c(NH4+)由大到小的顺序是:①>③>②
B.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-)
C.0.2mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.0.1 mol·L-1的NH4Cl溶液与0.05mol·L-1NaOH溶液等体积混合:
c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
17.X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述不正确的是( )
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的熔融化合物制取Y单质
D.Y、Z元素的最高价氧化物对应的水化物不能互相反应
16.有下列五个化学方程式(X、Y、Z均为正值):
①C2H2(g)+H2(g)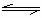 C2H4(g)
C2H4(g)
|
 C2H4(g)
C2H4(g)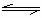 CH4(g)
CH4(g)
③C(s)+2H2(g)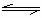 CH4(g);△H=-X kJ·mol-1
CH4(g);△H=-X kJ·mol-1
④C(s)+ H2(g)
H2(g)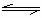
 C2H2(g);△H=-Y kJ·mol-1
C2H2(g);△H=-Y kJ·mol-1
⑤C(s)+H2(g)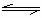
 C2H4(g);△H=-Z kJ·mol-1
C2H4(g);△H=-Z kJ·mol-1
当温度下降时①式平衡向右移动,②式平衡也向右移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是 ( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
15.在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)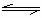 E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是 ( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是 ( )
A.4min时,M的转化率为80%
B.前4min,用M表示的平均反应速率为0.8mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com