
题目列表(包括答案和解析)
12. 3.1,4-二氧六环是一种常见的溶剂,它可以通过下列方法合成,则烃A为 ( )
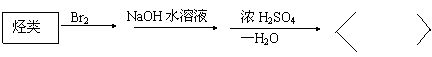 CH2-CH2
CH2-CH2
A B C O O
CH2-CH2
A.1-丙烯 B.1,3-丁二烯 C.乙炔 D.乙烯
10.X、Y均为短周期元素,且X为IA族元素,Y为VIA族元素。下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C.X2Y既可能是离子化合物,也可能是共价化合物
D.由X、Y组成的化合物中,X、Y的原子个数比不可能是1:1
|
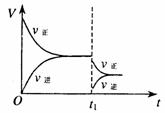
 11.在密闭容器中进行2SO2+O2 2SO3(g)(正反应放热)。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时
11.在密闭容器中进行2SO2+O2 2SO3(g)(正反应放热)。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时
刻突然变化的条件可能是( )
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
9.某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是 ( )
A.Na+、NO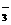 、Cl-、SO
、Cl-、SO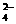 B.Na+、K+、Ba+、HCO
B.Na+、K+、Ba+、HCO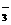
C.Fe3+、H+、SO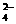 、Cl- D.Na+、K+、Cl-、SO
、Cl- D.Na+、K+、Cl-、SO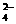
8.
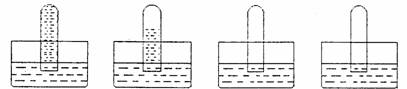 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是 ( )
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是 ( )
A盐酸 B水 C饱和食盐水 D水
6.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
|
A.Cu2S在反应中既是氧化剂,又是还原剂
B.该反应的氧化剂只有Cu2O
C.Cu既是氧化产物又是还原产物
D.每生成19.2gCu,反应中转移0.6mol电子
30、(10分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
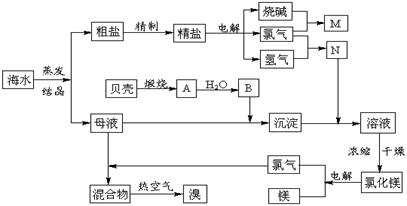
请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为____。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是 。
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
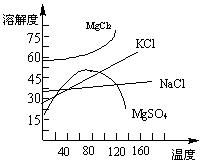 A.精制饱和食盐水进入阳极室
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(4)母液中常含有MgCl2、NaCl、MgSO4、KCl等,
可进一步加工制得一些重要的产品。若将母液加热升
温到60℃以上,随着水分的蒸发,会逐渐析出晶体,
此晶体的主要成分是__________________;过滤上述
晶体后,将滤液降温到30℃以下,又逐渐析出晶体,
用一定量的冷水洗涤该晶体,最后可得到比较纯净
的 晶体。
答案:(1)D、E、C (3分) (2)在HCl气流中脱水,防止MgCl2水解(2分)
(3)D (2分) (4)MgSO4 、NaCl;KCl(3分)
29、(10分)有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A.E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ① ,G ② ;
(2)D的前一元素第一电离能高于D的原因: ③ ;
(3)由A、B、C形成的ABC分子中,含有 ④ 个σ键, ⑤ 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ⑥ (写化学式),原因是 ⑦ ;
答案:① S (1分) ② Mg (1分) ③ D的前一元素是P,P的3p能级为半充满状态的3p3,是稳定结构;而S元素的3p能级3p4,是不稳定的结构。故P的第一电离能高于S(3分)
④ 2 (1分) ⑤ 2 (1分) ⑥ MgSO4 (1分) ⑦ MgSO4的晶格能大于K2SO4的晶格能。(2分)
28、(10分)已知A为芳香烃的衍生物,只含C、H、O三种元素,苯环上只有两种取代基,并且这两种取代基处于邻位,A的相对分子质量为164。A不能使FeCl3溶液变色,但可被银氨溶液氧化为B;B能在浓H2SO4存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环(与苯环共用2个C原子)。
(1)B分子中的含氧官能团是 。
(2)已知醛基(-CHO)是一个平面结构,则醛基中C原子的杂化方式是 杂化。A的侧链核磁共振氢谱有 个信号峰,其比例为(由小到大) 。
(3)试写出其中的任意两种A及其对应的C的结构简式(请按对应关系分组填写)
第一组A C
第二组A C
答案:(1)-COOH、-OH (共2分)(2)sp2 (2分) 5 (1分) 1∶1∶1∶2∶3(1分)
(3)第一组 A  C
C 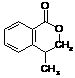 第二组 A
第二组 A 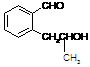 C
C 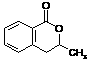 (共4分)
(共4分)
|
实验序号 |
KClO3的质量/g |
A的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
请回答:上述实验中的待测数据应是 ;
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:
。
II、已知下列化学反应:2H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 5O2↑+ MnSO4 + 8H2O。某化学研究性学习小组在做此实验时发现:在敞口容器中, 当H2O2与酸化的KMnO4 溶液混合时,开始放出氧气的速率很慢,一段时间后产生氧气的速率很迅速,经过测定发现溶液中温度变化不大,学生百思不得其解,经向老师询问,老师说:影响化学反应速率的外界因素有浓度、温度、压强和催化剂,现随着反应的进行,反应物的浓度在逐渐降低,敞口容器的压强不受影响,反应的温度变化不大,则可能的因素是催化剂的影响。在老师的提示下学生又做了三个对比实验如下:
(1)空白实验
(2)起始时加入少量K2SO4固体
(3)起始时加入少量MnSO4固体
(4)起始时加入少量水
结果发现(1)、(2)起始反应速率差不多,(4)的起始反应速率比(1)、(2)慢,(3)的起始反应速率很快。请解释(1)实验中反应速率的变化现象的原因是: ________________________________ __。
答案:I、相同条件下收满500mL氧气所用的时间(2分);不同催化剂的催化效果对照研究(2分)。
II、反应生成的MnSO4对此反应起催化作用,故反应速率先慢后快(2分)。
27、(7分)化学平衡现有反应:CO(g)+H2O(g)  CO2(g)+H2(g)(正反应为放热反应),在850℃时,K=1。
CO2(g)+H2(g)(正反应为放热反应),在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)平衡常数的表达式为 。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填"正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%和b%则a b(填“大于”、“小于”或“等于”)。
答案:(1)小于(1分)K=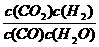 (1分) (2)①逆反应 (1分) ②0≤x<3.0 (2分) (3)小于(2分)
(1分) (2)①逆反应 (1分) ②0≤x<3.0 (2分) (3)小于(2分)
|
实验序号 |
KClO3的质量/g |
MnO2的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com