
题目列表(包括答案和解析)
1.下列各项是关于玻璃棒在若干实验中的用途及操作,其中错误的是:( )
①溶解物质时搅拌 ②蘸取少量溶液测其pH值 ③加热坩埚中固体物质时用玻璃棒搅拌 ④过滤时用玻璃棒引流,其下端在漏斗内滤纸的任意部位⑤配制一定体积的物质的量浓度的溶液用玻璃棒引流
A.③④⑤ B.④⑤ C.只有④ D.全部
21.某天然碱可看作是由二氧化碳和氢氧化钠反应后的产物组成的纯净物。称取该天然碱样
品2.50g,用经煮沸的蒸馏水配成250mL样品溶液。为分析其组成,做了以下两个实验:
①取25.00mL样品的溶液注入锥形瓶中,加2滴甲基橙,用盐酸溶液滴定,直至黄色溶液恰好变为橙色,消耗0.1000mol/L的盐酸35.00mL。
②取25.00mL样品溶液注入锥形瓶中,加入30.00mL 0.1000mol/L的氢氧化钡溶液,再加入2滴酚酞溶液,用0.1000mol/L的盐酸滴定过量的氢氧化钡,消耗盐酸的体积为45.00mL(滴定时沉淀碳酸钡不会溶解)。
(1)写出实验②中,样品溶液与氢氧化钡溶液反应的化学方程式。
(2)试分析计算样品溶液中Na2CO3、NaHCO3的物质的量的浓度
20.锰化学丰富多彩,但锰的三价化合物并不多见,某化学活动小组用高锰酸钾、草酸晶体
(H2C2O4·2H2O)和碳酸钾为主要原料合成三草酸锰(Ⅲ)化钾K3[Mn(C2O4)3]晶体。
反应原理:2MnO4-+8H2C2O4=2Mn2++10CO2↑+3C2O42-+8H2O
H2C2O4+CO32-=C2O42-+CO2↑+H2O
4Mn2++MnO4-+11C2O42-+4H2C2O4=5[Mn(C2O4)3]3-+4H2O
实验步骤:
①将0.057mol H2C2O4·2H2O放入盛有45mL水的烧杯中,水浴加热使草酸溶解。
②边搅拌边缓慢加入0.01mol KMnO4,继续水浴加热。
③当该混合物变成无色时,少量分批慢慢加入0.009mol K2CO3。
④冰水浴中充分冷却后,在强烈搅拌下,少量多次加入0.002mol KMnO4,全部加完之后,继续搅拌10分钟,将出现的白色沉淀物过滤掉,用烧杯收集滤液,并以冰水浴冷却。
⑤向滤液中加入35mL经冰冷却的乙醇,用铝箔纸包住烧杯,并置于冰中冷却两小时。
⑥过滤⑤所得的鲜红色的三草酸锰(Ⅲ)化钾晶体,干燥,保存于棕色试剂瓶中。
回答问题:
(1)写出25Mn的基态原子的电子排布式 ;
(2)实验步骤②反应进行的速度是很慢的,但可被Mn2+催化,设计一个实验加以验证
;
(3)实验步骤④中使用冰水浴冷却的原因主要是由天三草酸锰(Ⅲ)化钾 ;
(4)实验步骤⑤中乙醇的作用 ;
(5)铝箔纸包住烧杯冷却及用棕色瓶保存是由于三草酸锰(Ⅲ)化钾 ;
(6)三草酸锰(Ⅲ)化钾的理论产量为 mol,剩余的离子恰好组成步骤④中出现的白色沉淀物,其化学式为 。
19.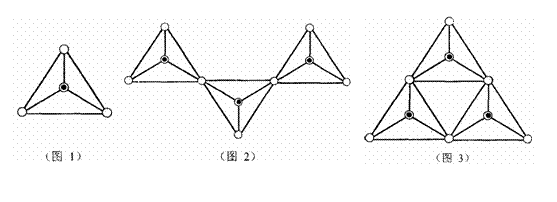 硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1,图中○表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)
硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1,图中○表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)
(1)形成硅氧四面体是硅与氧成键的一个重要特征,试再举两种含有[SiO4]单元的物质(要求不同种类) 。
(2)最简单的硅酸盐是硅酸钠,硅酸钠溶液中滴入酚酞显红色。试用离子方程式解释酚酞变红的原因 ,通入CO2能使上述溶液的红色褪色,离子方程式
。
(3)将某些盐混进硅酸钠溶液时,此盐会向上扩散长成很漂亮的树状,且此树会保留金属离子的特征颜色,例如CuSO4·5H2O和Na2SiO3溶液发生水解反应长成蓝色的树,NiSO4·7H2O则会长成绿色的树,写出加入CuSO4·5H2O长成蓝树的离子方程式 。
(4)图1为SiO44-,图2、图3所示硅酸盐离子的符号 、
(5)由13个正四面体结合成的环状结构Si13O3722-离子中,其中有 个正四面体和另外的四面体共享2个顶点、 个和另外的四面体共享3个顶点。
18.下图中,A、E、G在常温下为气态非金属单质,B、L为短周期金属单质,D、I分子
中均含有10个电子,其中I是一种重要的能源。C是由两种常见元素组成的化合物,K是一种由金属氧化物组成的耐高温材料,J是一种非常稀有的矿石,它由三种元素组成,原子个数比为3:1:6,在K电解时J能降低K的熔点。
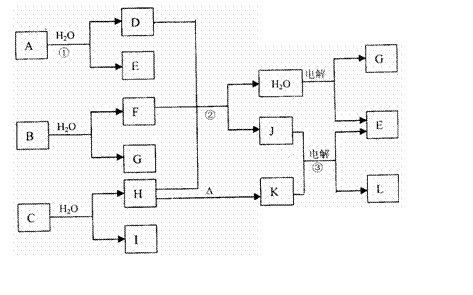
请按要求回答:
(1)写出C的化学式 ,F的电子式 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
(4)反应③的阳极反应式为 。
17.六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3及⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗? (填“能”或“不能”)
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ;有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是 ,其中涉及氧化还原应的化学方程式为
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
。
(4)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的上述 (填编号)防止水解,若能再加上 (填物质名称)效果会更好。实验室由FeSO4溶液得到晶体的实验操作为
,为了提高硫酸亚铁晶体在空气中的稳定性,实验时常在FeSO4溶液中加入一定量的(NH4)2SO4晶体,试分析(NH4)2SO4提高FeSO4在空气中稳定性的原因 。
16.在一定的浓度和温度下,HNO3与Fe反应后得到的还原产物为NO2和NO,它们的物质的量之比为1:3。1mol Fe消耗HNO3的物质的量可能为 ( )
A.2.6mol B.2.8mol C.4.0mol D.6.0mol
|
15.偏二甲基肼(CH3)2NNH2及N2O4(均为液体)的燃料/氧化剂体系常被用于空间飞行器的推进燃料。现将这两种物质混合,得到的产物只有N2、CO2和H2O(g)。1mol(CH3)2NNH2完全进行上述反应得到气体的总物质的量为 ( )
A.5mol B.7mol C.9mol D.11mol
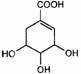
14.莽草酸(Shikimic acid) 在生物合成氨草酸、类固醇的过程中扮演着非
 常重要的角色。莽草酸在自然界中经过一系列的酶促反应转化为chorismic acid
常重要的角色。莽草酸在自然界中经过一系列的酶促反应转化为chorismic acid
。1mol Shikimic acid和1mol chorismic acid完全中和时分别消耗NaOH
( )
A.4mol、3 mol B.1mol、2mol C.1mol、3mol D.1 mol、4 mol
13.向60mL 1mol/L HCl和1mol/L AlCl3的混合溶液中,逐滴加入1mol/L的NaOH溶液,当生成的沉淀的质量为1.5g时,消耗NaOH的体积可能为 ( )
A.60mL B.120mL C.220mL D.280mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com