
题目列表(包括答案和解析)
2、乙酸化学性质
(1)与CaCO3的反应化学方程式: ;
(2)乙酸的酸性比碳酸的 ;与乙醇的酯化反应化学方程式: ;酯化反应是 反应,反应进行的比较缓慢,反应物不能完全变成生成物;为防爆沸需加入 ,为了提高反应速率,一般要加入做催化剂,并加热。
(3) 酯化反应实质:有机羧酸脱___,醇脱______。
疑难点拨
1.乙醇化学性质
(1)与金属钠的反应化学方程式 ;
(2)与氧气的反应化学方程式: ;
(3)在焊接铜漆包线的线头时,常把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下再焊接,这是因为(用化学方程式表示):
① ②
(4)钠分别与水、乙醇反应的比较
|
|
钠与水的反应实验 |
钠与乙醇的反应实验 |
|
钠的现象 |
|
|
|
声的现象 |
有“啧啧”的声音 |
无任何声音 |
|
气的现象 |
观察不到气体的现象 |
有无色、无味气体生成,作爆鸣实验时有爆鸣声 |
|
实验结论 |
钠的密度小于水的密度,熔点低。钠与水剧烈反应,单位时间内放出的热量大,反应生成氢气。2Na + 2H2O == 2NaOH +H2↑水分子中氢原子相对较活波 |
钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na + 2C2H5OH→ 2C2H5ONa
+ H2↑乙醇分子里羟基氢原子相对不活泼 |
|
反应实质 |
|
|
(5) 乙醇的分子结构与化学性质的关系

2、乙酸:分子式:___;结构式:_____; 结构简式:_____。官能团是_____。
1、乙醇:分子式:___;结构式: ____;结构简式:____或_____。官能团是
6.4g-5.6g==0.8g,
∴B的酸值范围是:A-5.6 < B < A+0.8 共3分。
⑶由⑵计算得知,耗用铁为0.1mol,
则:5.6g-W(Cu) ==5.0g
W(Cu) ==0.6g 共3分。

|
|
|
|
|
|

|
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效! |
|
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效! |
26、⑴ ∵Ag++Cl-====AgCl↓
∴20mL滤液中含有Cl-为:
n(Cl-) ==n(Ag+)==0.60mol/L×0.1L==0.06mol
原FeCl3溶液中,n(FeCl3) ==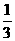 n(Cl-) ==0.06mol×
n(Cl-) ==0.06mol×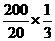 ==0..2mol
==0..2mol
C(FeCl3) == ==1mol/L
共3分。
==1mol/L
共3分。
⑵由⑴计算知:n(FeCl3) ==0.2mol
若铜尚未溶解,耗铁0.1mol,固体减重5.6g。
若最多溶解0.1mol铜后,耗铁仍为0.1mol,但有0.1mol铜生成,则固体增重:
25、⑴ ∵pH==14,
∴c(OH-) ==1mol/L. (1分)
n[Ba(OH)2] ==n(BaCO3)
==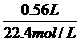 ==0.025mol
==0.025mol
n(NaOH) ==0.1L×1mol/L-0.025mol×2==0.05mol (2分) 共3分
⑵ 通入CO2气体V1L时,生成了0.025molBaCO3沉淀。
溶液中溶质为0.05molNaHCO3。
V1==(0.025mol+0.05mol)×22.4L/mol==1.68L (3分)
通入CO2 V2L时,溶液中溶质为0.05molNaHCO3、0.025mol Ba(HCO3)2,
V2==(0.05mol+0.025mol×2)×22.4L/mol==2.24L (2分) 共5分。
24、⑴ 2CH3OH + 3O2 + 4OH- === 2CO32- + 6H2O (共2分)
⑵负 (1分) CH3OH-6e-+8OH-===CO32-+6H2O (2分) 共3分。
⑶13.44 (3分)
23、⑴A,C,E 共3分,每漏选1个扣1分,错选倒扣分,本题不得负分。
⑵正 (1分), 2H++2e-===H2↑(2分), NaClO(或ClO-) (2分) 共5分。
⑶Cl2 +2Fe2+ ===2Cl- +2Fe3+ , Fe3+ +3H2O 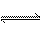 Fe(OH)3+3H+ 共4分
Fe(OH)3+3H+ 共4分
⑷高铁酸钠具有强氧化性,故可用于消毒。 2分
高铁酸钠还原产物为Fe3+,Fe3+水解产物Fe(OH)3吸附水中悬浮杂质,具有净水作用。(2分) 共4分。
22、⑴NH4+ NH2- 小于 共4分
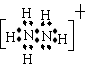
⑵ (共2分)
⑶N2H62++2OH-===N2H4+2H2O (共2分)
⑷CO2 HN3 N2O 共3分。其它合理答案同样给分。
⑸ 1 (1分) B (2分) 共3分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com