
题目列表(包括答案和解析)
2.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原
D.HCN的电子式为 
1.下列关于原子的几种描述中,不正确的是
A.18O与19F具有相同的中子数 B.12C与13C具有相同的质量数
C.16O与17O具有相同的电子数 D.15N与14N具有相同的质子数
23.(8分)某化学课外小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________ 。
⑶当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是______________
。
⑷为了使步骤2中的含铝离子沉淀完全,还可以应用的最佳试剂是____________ 。
22.(11分)右图中X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为 极。(用“正”、“负”、“阴”、“阳”填空)
②Z槽中e为 极(同上)。
③连接Y、Z槽线路中,电子流动的方向是d e(用“→”和“←”填空)。
(2)①写出c极上反应的电极反应式 。
②写出Y槽中总反应化学方程式 。
③写出Z槽中e极上反应的电极反应式 。
(3)①电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为 mol
②若Y槽中溶液体积为500mL(电解后可视为不变),则槽中单位时间内氢氧根离子浓度的变化是 mol/(L.min)。
21.(14分)咖啡酸( )也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野
胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是
(2)咖啡酸不具有以下哪些性质
A.在浓硫酸、加热条件下能发生消去反应
B.能与FeCl3发生显色反应
C.能发生银镜反应
D.一定条件下能发生酯化反应
(3)1mol咖啡酸与浓溴水反应时最多消耗 mol Br2,
反应类型有 ;
(4)咖啡酸一定条件下发生加聚反应的方程式
,
咖啡酸与NaHCO3溶液反应的方程式
。
(5)有机物A分子式为C9H10O2,A分子中含有一个甲基,A能发生水解反应,在溶液中1molA能与2molNaOH反应,写出符合上述条件的有机物A的结构简式 。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成y g H2O和m L CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式 。
第Ⅱ卷(非选择题 共56分)
19.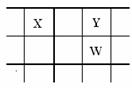 (12分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
(12分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
(1)五种元素形成的单质,其中,固态时属于原子晶体的是: (填化学式);
常用做强氧化剂的是 、 (填化学式)。
(2)这五种元素中,原子半径最大的是: (填化学式);
由Z、W、Q形成的简单离子半径由大到小的顺序是: (用化学式表示);X、W、Q最高价氧化物的水化物酸性从强到弱的顺序是: (用化学式表示);
(3)Z与Q反应生成的化合物属于 化合物;电解该化合物的饱和溶液,阳极的电极反应式为: ;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。
(4)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9g该化合物燃烧放出140 kJ的热。
写出该化合物燃烧热的热化学方程式: 。20.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
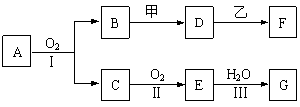
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 (填设备名称)中进行,工业上反应Ⅲ用于吸收E的试剂是 。
②D的水溶液呈 性(填“酸”、“碱”或“中”)。
③反应Ⅰ的化学方程式是______________________________________________ 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出甲物质的电子式是 。
②写出D到F的反应化学方程式是______________________________________。
③把盛满E物质的烧瓶封闭后放在冰水中冷却,一会儿观察到的现象是 。
反应的化学方程式是____________________________________ 。

18.有X、Y、Z、W 四种金属进行如下实验:
|
1 |
将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
|
2 |
将X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
|
3 |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实的下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入 CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸构成的原电池,X做负极
第Ⅰ卷(选择题 44分)
17.下列实验 操作不合理的是
①用FeCl3溶液鉴别乙醇溶液和苯酚溶液
②用溴水检验汽油中是否含有不饱和脂肪烃
③用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
④仅用蒸馏水鉴别蔗糖、硫酸铜粉末、碳酸钙粉末
⑤用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH
⑥配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
⑦在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
A.①⑤⑥ B.④⑦⑧ C.②④⑤⑧ D.①④⑦
16.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.T的氢化物沸点高于Q的氢化物沸点 B.L、M的单质与稀盐酸反应速率:M > L
C.T、Q的氢化物常态下均为无色气体 D.L、Q形成的简单离子核外电子数相等
14.奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构如右图),
 下列说法正确的是
下列说法正确的是
A.羊毛与聚酯纤维的化学成分相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇 D.聚酯纤维和羊毛都属于合成纤维常温时,将15.a1 mL b1 mol/L 的CH3COOH溶液加入到a2 mL b2 mol/L 的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com