
题目列表(包括答案和解析)
22.(9分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
[查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的PH:Ca(OH)2:PH≥13;A1(OH)3;PH≥5.5;Fe(OH)3:PH≥4.1]

试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是 ;
(2)写出检验Ca2+的离子方程式 ;
(3)写出沉淀C所含主要物质的化学式 ;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 ;
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。
21.(10分)实验室中根据2SO2+O2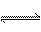 2SO3;ΔH=-196.6 kJ·mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:
2SO3;ΔH=-196.6 kJ·mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:

(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)____________________。
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是___________________________________________________________________。
(3)小试管C的作用是______________________________________________________。
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是________________________________。
(6)装置G的作用是________________________________________。
(7)从G装置导出的尾气处理方法是________________________________________。
20.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl-)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
第Ⅱ卷(非选择题,共80分)
19.“喷水溶液法”是日本科学家最近研制出的一种使沙漠变绿洲的技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30-50cm处形成一个厚0.50cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用,下列对聚丙烯酸酯的说法错误的是
A.它的单体的结构简式为CH2=CHCOOR B.它在一定条件下能发生加成反应
C.它在一定条件下能发生水解反应 D.它具有固定熔沸点
18.在体积、温度都相同的条件下有下列反应:2A(气)+2B(气)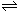 C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,Ⅰ途径的反应速率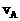 等于Ⅱ途径的反应速率
等于Ⅱ途径的反应速率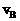
D.达平衡时,Ⅰ途径所得混合气的密度为Ⅱ途径所得混合气密度的1/2
17.第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x的单质一定是良好的半导体材料
D.x元素在常温下稳定存在的氧化物一定能与烧碱反应
16.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.PH为14的溶液:S2-、SO32-、 S2O32-、Na+
C.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ca2+
D.滴加石蕊试液呈红色的溶液:K+、SO42-、NO3-、NH4+
15.某混合气体可能含N2、HCl、CO中的一种或几种,将其依次通过足量NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积减小;最后通过灼热的铜丝,充分反应后气体体积又减小,但还有气体剩余。以下判断中,正确的是
A.一定有N2和HCl,没有CO B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl D.一定没有N2,CO和HCl中至少有一种
14.某空气污染监测仪是根据SO2与Br2、H2O的定量反应来测定空气中SO2含量的。上述反应的溴,来自一个装有酸性(H2SO4)KBr溶液的电解槽阳极上的产物,电解槽的阳极室和阴极室是隔开的。当测量某地区空气中SO2含量时,空气(经过除尘)以一定的流速进入电解槽的阳极室,电流计显示每秒通过的电子的物质的量,此时保持溴浓度恒定并恰好与SO2完全反应(空气中不含其它与溴反应的杂质)。那么在此监测过程中发生的主要反应的离子方程式和电解槽中阳极上的电极反应式正确的一组是
①2Br-- 2e- = Br2
②4OH--4e- = O2↑+ 2H2O
③2H++2e- = H2↑
④SO2 + Br2 + 2H2O = 4H++ SO42-+2Br-
⑤2SO2 + O2 + 2H2O=2SO42-+ 4H+
A.⑤① B.⑤② C.④① D.④③
13.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2+ + HCO3- + OH-=== CaCO3 ¯ + H2O
B.碳酸钠溶液与醋酸反应
CO32- + 2H+ = CO2↑+ H2O
C.Ca (ClO)2溶液中通入过量的二氧化硫气体
Ca2+ + 2ClO- + H2O + SO2 = CaSO3 ¯ + 2HClO
D.用碳棒作电极电解氯化钾饱和溶液
2Cl- + 2H2O 2OH- + Cl2
+ H2
2OH- + Cl2
+ H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com