
题目列表(包括答案和解析)
3.下列物质加入水中,使水的电离程度增大,且所得溶液显酸性的是
A.CH3COOH B.Al2(SO4)3 C.NaOH D.Na2CO3
2.下列物质的水溶液能导电,但属于非电解质的是
A. CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
1.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为:
A.同系物 B.同分异构体 C.同素异形体 D.同位素
29.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
 (2)
上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
(2)
上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
28.(10分)
已知①两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

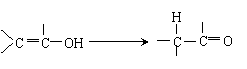 ② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
现有分子式为C9H8O2Br2的物质M,可在一定条件下发生下述一系列反应 :
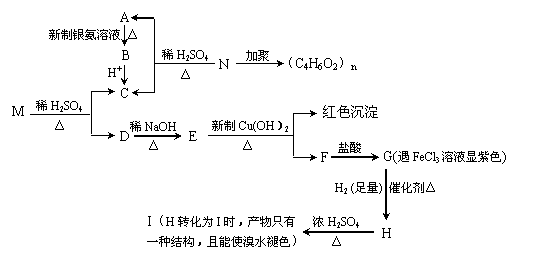
请回答下列问题:
⑴G→H、H→I的反应类型分别是 。
⑵M的结构简式为 ;N的结构简式为 。
⑶写出下列反应的化学方程式:
①A→ B的化学方程式 ;
②H→I的化学方程式 ;
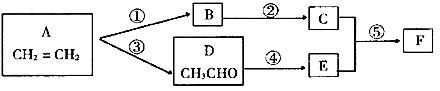
27.(9分)由乙烯合成有机物F(二乙酸乙二酯),采用下列合成路线:
|
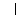 (1)已知有机物COOCH3的名称为乙二酸二甲酯。请写出F的结构简式
(1)已知有机物COOCH3的名称为乙二酸二甲酯。请写出F的结构简式
COOCH3
(2)在上述反应中属于取代反应的有 (填反应代号)。
(3)A、D、E、F中能引入C中官能团的物质有 (填反应物代号),其反应⑤的化学方程式分别为
26. (12分)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α随溶液PH变化的关系如图所示:
(12分)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α随溶液PH变化的关系如图所示:
(1)草酸钠溶液中,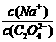 2(填“﹥” “==” 或“﹤”);往该溶液中滴入氯化钙溶液后,
2(填“﹥” “==” 或“﹤”);往该溶液中滴入氯化钙溶液后,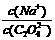 增加,可能的原因是
。
增加,可能的原因是
。
(2)往草酸钠溶液中滴稀盐酸,PH=5时溶液中存在的阴离子有 ,PH=3时,以上两种物质发生的主要反应的离子方程式为 。
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是 。
(4)将适量草酸亚铁(FeC2O4·H2O)粉末加入试管中,在酒精灯上边加热边摇动,发生剧烈反应,产生气体克使燃着木条熄灭,生成黑色粉末。反应将结束时,将所得的黑色粉末撒在石棉网上,便会立即自燃起来。
草酸亚铁粉末受热分解的化学方程式为 ,自燃的原因是 。
(5)下表为几种酸对铁锈及锅炉水垢的溶解性比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 |
0.7911 |
全溶 |
|
磷酸 |
0.1586 |
微溶 |
|
草酸 |
0.7399 |
0.0036 |
|
醋酸 |
0.1788 |
0.1655 |
下列说法正确的有 。
A.同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好
25.(10分)亚硝酸钠易溶于水,有咸味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2 + KI +  NO + I2 + K2SO4
+ Na2SO4 + H2O
NO + I2 + K2SO4
+ Na2SO4 + H2O
(1)完成该化学方程式并配平。
(2)用上述反应来处理NaNO2并不是最佳方法,其原因是_____________________________。从环保角度来讲,要处理NaNO2,所用的物质的_________(填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(3)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O
请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一:__________________________________________________________。
方法二:__________________________________________________________。
(4) 现有25.00 mL的KI溶液,用酸化的10.00 mL 0.05000 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.15 mL,原KI溶液的物质的量浓度为 。
24.(8分)一种火箭推进剂是由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸汽,并放出大量热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸汽,放出256.65kJ的热量。
(1)写出肼(N2H4)的电子式 ;
(2)反应的热化学方程式为 ;
(3)反应中的氧化剂是 ;
(4)当有1 mol氮气生成时,反应转移的电子数为 NA;
(5)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
23.(12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
 实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录
|
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO4)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com