
题目列表(包括答案和解析)
21.在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g) 2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
A.2-Saob B.1-Saob C.2-Sabco D.1-Sboc
22 在一定温度下,反应2HBr(g) 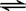 H2(g)+Br2(g) △H >O
H2(g)+Br2(g) △H >O
达到平衡时,要使混合气体颜色加深,可采取的方法是
A. 减小压强 B. 缩小体积 C. 降低温度 D. 增大氢气浓
20. 2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
A.土卫六上存在有机分子 B.地表温度极高
C.地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统
19. 某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
A、晶体中与每个A+距离最近的A+有12个
B、晶体中,阴离子与阳离子个数之比为1:1
C、该离子晶体化学式为A2O2
D、晶体中,0价氧原子与-2价氧原子的数目比为3:1
18. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 则下列叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
17. 右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
一段时间后,所观察到的实验现象(反应过程中产生的气体收集
在试管上部的气球中)。下列说法正确的是
A.甲试管中盛放的是盐酸溶液
B.甲试管中盛放的是醋酸溶液
C.图中所示的反应瞬间,甲试管中溶液的pH小于乙试管中溶液的pH
D.图中所示的反应瞬间,甲试管中溶液的pH大于乙试管中溶液的pH
16. 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动 C. 平衡向正反应方向移动
D. 物质C的质量分数增大
15. 接触法制硫酸通常在400-500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g) + O2(g)  2SO3(g) ;
2SO3(g) ;
△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
D.高压有利于加快反应速率,可以提高生产效率
14.下列反应的离子方程式书写正确的是
A.浓烧碱溶液中加入铝片:Al+2OH- = AlO2- +H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42 -+Ba2++2OH- = BaSO4↓+2H2O
13.下列叙述中正确的是
A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与18 g NH4+ 所含质子数相等
12.设NA为阿伏加德罗常数,下列叙述中正确的是
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com