
题目列表(包括答案和解析)
32. 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各分别为 mol
mol (用含有a的式子表示)
31. (6分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀 ;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤有 ,A与水反应后生成的溶液中含有的离子可
能有 。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,
沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式
30.(6分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出该反应离子反应方程式:
(2)在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH=12的NaOH
溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是
(填“强酸”或“弱酸”)。
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式
29.(6分)元素周期表是20世纪科学技术发展的重要理论依据之一,是我们学习化学的重要工具。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在周期表中的位置应该是第 周期第 族;“元素” NH4的单质常温常压下应为 (填“固”、“液”或“气”)体;熔点 (填“高”或“低”) ; (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水。
28.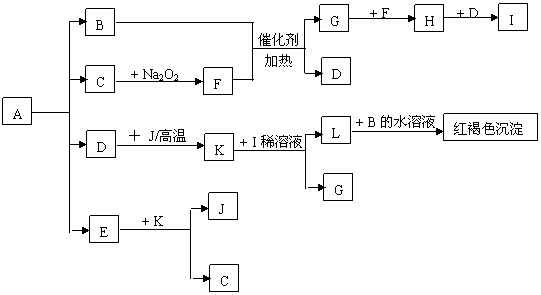 (10分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
(10分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
请按要求填空:
(1) 单质J的化学式_____________,E的分子式是______________
(2) 写出B和F反应的化学方程式______________________________
(3) 写出K和I的稀溶液反应的离子方程式
(4) A的化学式为______________________________
27.(8分)X、Y、Z、W是原子序数依次增大的短周期元素(稀有气体除外),其中两种为金属元素。X原子的原子半径是短周期元素中原子半径最大的,Y的单质可与浓NaOH溶液反应,X原子与Z原子最外层电子数之和为7。请回答下列问题:
(1) X和W形成的化合物的晶体类型为_______________
(2) Z的氢化物的相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,理由是___________________________
(3) Y的单质与浓NaOH溶液反应的离子方程式是
(4) 0.1molW的单质与50mL1.5mol/L 的FeBr2溶液完全反应,则反应中被氧化的Fe2+和Br-的物质的量之比是____________写出该反应
的离子方程式
26、(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是 。
25. 在一恒定的容器中充入2molA和1molB发生反应:2A(气)+B(气) xC(气),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol 、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
xC(气),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol 、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A、只能为2 B、只能为3
C、可能是2,也可能是3 D、无法确定
第Ⅱ卷(非选择题50分)
24.下列事实不能用勒沙特列原理解释的是:
A.向饱和的胆矾溶液中加入一些无水硫酸铜粉末,很快有较多量的蓝色晶体形成
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率。
23.某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) 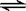 C(g)+D(g),5分钟后达到平衡。已知各物质的平衡浓度的关系为[A]a[B]=[C][D],若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5分钟后达到平衡。已知各物质的平衡浓度的关系为[A]a[B]=[C][D],若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A. 60% B. 24% C. 4% D. 40%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com